Контрольная работа: Химические свойства альдегидов и кетонов. Присоединение кислородных нуклеофилов
4-оксипентаналь
Полуацетали при взаимодействии со второй молекулой спирта в присутствии сильных кислот и при условии удаления воды в результате реакции нуклеофильного замещения могут превращаться в полные ацетали.
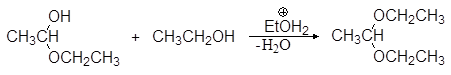 (36)
(36)
1,1-диэтоксиэтан
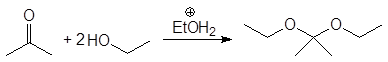 (37)
(37)
Механизм образования ацеталей и кеталей на первом этапе AN, а на втором SN1.
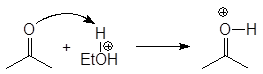
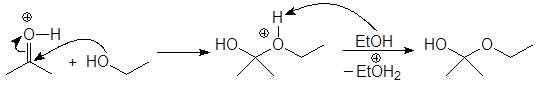 (м 6)
(м 6)
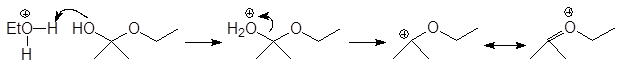
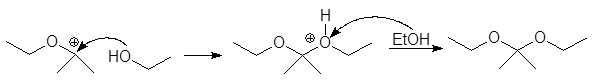
Вместо двух молекул спирта можно использовать одну молекулу диола:
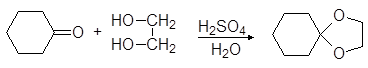 (38)
(38)
этилендиоксициклогексан
Ацетали обладают структурой простых эфиров и подобно простым эфирам устойчивы к щелочам и нуклеофильным реагентам, но гидролизуются водными кислотами, причем гораздо легче, чем простые эфиры: уже при комнатной температуре под действие разбавленных минеральных кислот:
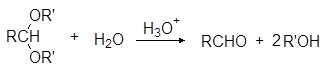
Устойчивость ацеталей и кеталей к действию нуклеофильных реагентов позволяет защищать карбонильную группу при проведении реакции по другим группам с нуклеофильными реагентами. После чего карбонильную группу рекуперируют. Для такой защиты чаще всего используют этиленгликоль:
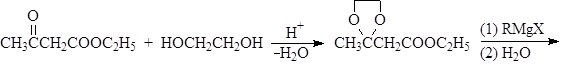
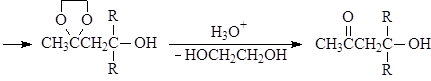
Присоединение серосодержащих нуклеофилов.
Атом серы тиолов является лучшим нуклеофилов, чем атом кислорода спиртов. Тиолы реагируют с карбонильными соединениями в кислой среде, образуя дитиоацетали.
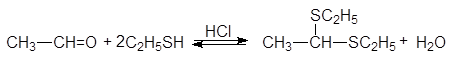 (39)
(39)
1,1-ди(этилтио) этан (дитиоацеталь)
С этилендитио-1,2-диолом и 1,3-пропандитиолом образуются циклические тиоацетали.
При нагревании тиокеталей с никелем Ренея в спирте происходит десульфурирование, в результате чего исходная карбонильная группа превращается в метиленовую и таким образом достигается восстановление альдегидов и кетонов в углеводороды.
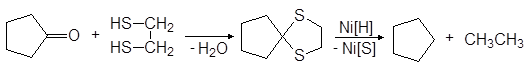 (40)
(40)
циклический тиокеталь
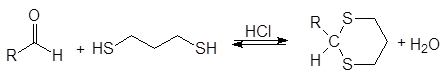 (41)
(41)
1,3-пропандитиол 1,3-дитиан
(циклический тиоацеталь)