Курсовая работа: Особенности накопления тяжелых металлов высшими водными растениями водоемов и водотоков г. Гомел
Погруженные макрофиты оз. Волотовское имеют максимальные значения Кн никеля при повышенном содержании его в грунтах водоема (в 4, 0 - 34 раза выше, чем у представителей группы в других водоемах). Видимо, как и в случае с растениями оз. Малое при накоплении свинца и хрома, у макрофитов оз. Волотовское нарушились защитные механизмы, предотвращающие излишнее поступление металлов в растения. В оз. Володькино различия в накоплении никеля погруженными, воздушно - водными и плавающими прикрепленными растениями составляют 17 раз. Это еще раз подтверждает предположение о существовании различных механизмов поступления металлов в водные растения. Высокой поглотительной способностью по отношению к никелю характеризуются погруженные растения озер Дедно и Круглое в сравнении с плавающими прикрепленными видами (у погруженных растений значение Кн в 7 раз выше). В оз. Любенское величина коэффициента накопления элемента у растения III группы в 13, 5 раз выше в сравнении с макрофитами IV группы. Микроконцентраторами и «накопителями» никеля являются погруженные растения III группы озер Володькино и Волотовское. Следует отметить тот факт, когда при высокой накопительной способности растений III группы в оз. Волотовское, у растений IV группы данного водоема элемент не обнаружен. Не накапливают металл представители II группы, отобранные в старице, р. Сож ниже города и в Гребном канале, а также растения III группы из р. Сож выше города. Все остальные изучаемые макрофиты относятся к деконцентраторам и «исключителям» данного элемента. По величине коэффициентов поглощения никеля для растений разных экологических групп можно выстроить следующий ряд: Кн III гр. > Кн IV гр. > Кн II гр. Как и в случае с медью, в некоторых водоемах (озера Малое, Шапор, р. Сож выше и ниже города) макрофиты IV группы накапливают никель интенсивнее, чем растения III группы. Пороговые концентрации элемента для растений в донных отложениях находятся в диапазоне от 10 до 20 мг/кг сухой массы (рис. 5).
При сравнительно одинаковом содержании никеля и ванадия в донных осадках исследуемых водоемов последний поглощается водными растениями в значительно меньшей степени – значения коэффициентов накопления ванадия не превышают 0.25 (Гребной канал). Не накапливают металл грунты старицы и в растениях водоема элемент не обнаружен. Низкая аккумулирующая способность по отношению к ванадию отмечена у плавающих прикрепленных растений II группы во всех изучаемых водоемах. Как и в случае с хромом, в четырех из шести водоемов опробования макрофиты не аккумулируют металл вообще, а в двух других значение Кн минимально. Максимальными значениями Кн элемента отличаются погруженные растения Гребного канала, что не соответствуют общей тенденции, так как в грунтах водоема не отмечается повышенного содержания металла. На втором месте по накоплению ванадия находятся погруженные макрофиты оз. Волотовское с минималым содержанием элемента в донных отложениях. Но в указанном водоеме, вопреки общей закономерности, ванадий не накапливается в воздушно - водных растениях IV группы. Для изучаемых растений наиболее четкие различия между значениями коэффициентов накопления ванадия отмечены у представителей II и III групп (рис. 6). Значения Кн у погруженных и воздушно - водных растений во всех водоемах отличаются незначительно (1, 5 - 2, 5 раза). Ряд накопления элемента для растений водоемов опробования выглядит следующим образом: Кн III э.г. > Кн IV э.г. > Кн II э.г .Изученные виды растений являются деконцентраторами и «исключителями» ванадия.
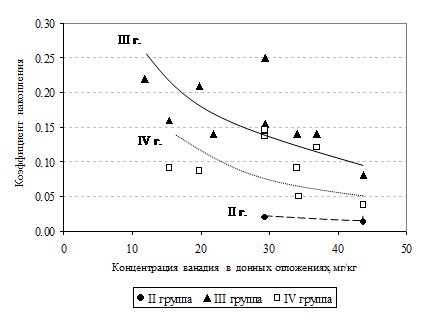
Рис. 6. Коэффициенты накопления ванадия в растениях различных экологических групп
Из всех изучаемых металлов больше всего вопросов возникает при рассмотрении накопления кобальта (рис. 7). При довольно низких концентрациях его в донных отложениях (в 100 раз меньше, чем марганца и в 10 – чем хрома и меди) коэффициенты накопления металла у растений были достаточно высокими, что говорит о нахождении элемента в биодоступных формах в донных отложениях отдельных водоемов опробования. Следует отметить, что у растений разных экологических групп одного водоема имеются значительные различия в аккумуляции кобальта. Например, в озерах Волотовское, Любенское и Дедно в воздушно - водных растениях элемент не накапливается, тогда как погруженные макрофиты водоемов активно аккумулируют кобальт из донных отложений (значение Кн в 2 - 5, 5 раза выше, чем у представителей группы в других водоемах). У плавающих прикрепленных растений ни в одном из изучаемых водоемов металл не обнаружен. Донные отложения оз. Круглое содержат максимальное количество элемента, но в растениях кобальт не накапливается вообще. Возможно, это связано с присутствием элемента в грунтах водоема в формах, недоступных для растений. Это также может быть вызвано работой блокирующих механизмов, предотвращающих поступления токсичных веществ в растительные организмы. Как было указано выше, дно оз. Круглое сильно загрязнено изучаемыми элементами и значения Кн практически для всех металлов у макрофитов озера минимальны. Это говорит о сильной активизации механизмов устойчивости растений оз. Круглое к токсическому действию металлов, что может полностью подавлять накопления кобальта в макрофитах водоема. При одинаковом содержании элемента на участках реки выше и ниже города, растения, собранные у д. Кленки (выше города) не содержат соединений никеля, что требует дальнейшего изучения. Значения коэффициентов накопления металла у погруженных растений в 1, 5 - 6, 5 раза выше, чем у воздушно - водных (за исключением макрофитов оз. Малое и Гребного канала). Активнее всех поглощают элемент из донных осадков погруженные растения озер Дедно, Володькино и Волотовское. Данные растения мы можем отнести к «индикаторам» кобальта, остальные являются деконцентраторами и «исключителями» металла. Минимальные значения Кн - у надводных растений Гребного канала и оз. Шапор. Погруженные виды водных растений занимают первое место по поглощению кобальта из донных отложений, за ними стоят надводные макрофиты, а прикрепленные растения с плавающими листьями не поглощают данный металл вообще.
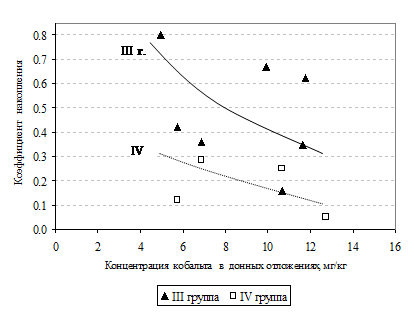
Рис. 7. Коэффициенты накопления кобальта в растениях различных экологических групп
Полученные данные позволяют сделать выбор объектов биомониторинга тяжелых металлов при изучении загрязнения водных экосистем. Ими могут быть макроконцентраторы марганца и никеля, а также «индикаторы» марганца, меди и кобальта, у которых значения Кн металлов близки к единице. Остальные растения являются деконцентраторами изучаемых металлов, и это может вызвать определенные сложности при использовании их в качестве объектов биомониторинга. Из графического материала видно, что интенсивнее всех поглощают минеральные вещества из донных осадков погруженные виды водных растений, в меньшей степени – надводные макрофиты. Низкая аккумулирующая способность, характерная для плавающих прикрепленных растений, затрудняет использование их в качестве мониторов загрязнения водоемов тяжелыми металлами. В процессе проведения исследований были установлены пороговые уровни содержания свинца, меди, марганца, никеля и хрома в донных отложениях водоемов опробования. По биодоступности для водных растений из донных осадков изучаемые элементы можно выстроить в следующий ряд: Mn>Co>Ni>Cu>Pb>V>Cr.
Заключение
Для большинства изучаемых металлов прослеживается тенденция снижения значения коэффициентов накопления элементов в растениях по мере увеличения их в донных отложениях: в диапазоне низких концентраций химических элементов в грунтах водоемов степень поглощения их растениями высока, а при высоких концентрациях у растений наблюдается насыщение элементом и степень его поглощения снижается – значение Кн стабилизируется. Таким образом, на доступность металла для растений влияют содержание и форма нахождения его в среде обитания, а также природа самого химического элемента. Можно предположить также, что для некоторых металлов процесс накопления их макрофитами определяется, в частности, критическими уровнями концентраций, при достижении которых происходит скачкообразный переход функционального состояния растения (в том числе, способность аккумулировать тяжелые металлы) на новый уровень устойчивости. Доступность металлов в донных отложениях для водных растений зависит также и от их биологии, позволяющей регулировать содержание химических элементов в различных видах даже при одинаковом количестве металлов в грунтах водоемов. Полученные данные могут быть использованы при решении такой проблемы, как оценка экологической емкости водных экосистем по отношению к тяжелым металлам.
Литература
1. Школьник М.Я. Микроэлементы в жизни растений. – М.: Наука, 1974. – 325 с.
2. Власюк П.А. Микроэлементы в обмене веществ растений. – Киев: Наукова думка, 1976. – 154 с.
3. Алексеев Ю.В. Тяжелые металлы в почвах и растениях. – Л.: Агропромиздат, 1987. – 142 с.
4. Кабата – Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях. – М.: Мир, 1989. – 436 с.
5. Ялынская Н.С., Лопотун А.Г. Накопление микроэлементов и тяжелых металлов в растениях рыбоводных прудов // Гидробиологический журнал. − 1993. - Т. 29, №5. С – 40-46.
6. Никаноров А.М., Жулидов А.В., Емец В.М. Тяжелые металлы в организмах ветлендов России. – С.-П.: Гидрометеоиздат, 1993. – 282 с.
7. Лукина Л.Ф., Смирнова Н.Н. Физиология высших водных растений. – Киев: Наукова думка, 1998. – 184 с.
8. Никаноров А.М., Жулидов А.В., Покаржевский А.Д. Биомониторинг тяжелых металлов в пресноводных экосистемах. – Л.: Гидрометеоиздат, 1985. – 143 с.
9. Савченко В.В., Вадковская И.К. Микроэлементы в водных растениях Беларуси (на примере рек Березина и Свислочь) // Природопользование. – 1996. – вып. 1. – С. 124-126.