Курсовая работа: Пиразолы, тетразолы и триазолы
Кроме того, имеется ряд менее общих методов, находящих применение лишь в отдельных случаях.
Практическое применение
Так как фенилгидразин является наиболее легкодоступным гидразином, особое внимание было уделено 1-фенилпиразолам, которые в настоящее время можно считать самыми важными и наиболее тщательно исследованными производными. Поскольку многие лекарственные препараты и красители содержат пиразольное ядро, этот класс соединений широко изучался и исследования продолжаются и теперь, несмотря на то, что антипирин и родственные медикаменты больше не используются в США. Пиразолоновые красители особенно важны в цветной фотографии.
2. Литературный обзор . Пиразолы, тетразолы и триазолы
2.1. Общие сведения
Производные этих гетероциклов представляют собой устойчивые ароматические соединения. Многие из них используются в промышленном производстве лекарственных препаратов, пестицидов и красителей. В качестве примеров можно привести гербицид соль пиразолия 9 (дифеиэокват), раксил (10) — фунгицид, используемый для зашиты растений, фенилбутазои (11) — противовоспалительное средство и флуконазол (12) — лекарственный препарат для лечения грибковых инфекций. Производные 1,2,3-триазола применяют в качестве оптических отбеливателей. Тетразолы имеют важное значение в медицинской химии, так как N-незамещенные тетразолы можно рассматривать как аналоги карбоновых кислот: величины их рК, сравнимы (разд. 8.1), и они представляют собой плоские, делокализованные системы с примерно такими же пространственными требованиями. Были синтезированы аналоги аминокислот и многих других природных карболовых кислот, в молекулах которых карбоксильная группа заменена тетразольным циклом.
. 
2.2. Получение пиразолов реакцией синтеза кольца
Эти гетероциклы можно синтезировать с помощью реакций замыкания цикла и циклоприсоединения. Наиболее общий метод получения пиразолов заключается во взаимодействии 1,3-дикарбонильных соединений или их аналогов (таких, как сложные эфиры енолов) с гидразинами. В качестве примера приведем синтез 3,5-диметилпиразола (13) из пентан-диона-2,4 и гидразина. Недостаток этого метода заключается в том, что несимметричные дикарбонильные соединения или их производные иногда образуют смеси изомерных пиразолов. К хорошим результатам в получении некоторых N-незамещенных пиразолов приводит взаимодействие гидразидов XCSNHNH2 (X=.SR или NR2) с а-галогенокетонами. В ходе реакции в качестве интермедиатов образуются тиадиазины 14, которые либо самопроизвольно, либо при обработке кислотами элиминируют атом серы и превращаются в пиразолы с хорошим выходом.

Пиразолы можно также получить циклизацией ацетиленовых гидразинов, электроциклизацией ненасыщенных диазосоединений, 1,3-диполярным циклоприсоединением диазосоединений и нитрилимидов.
Существует много удобных методов синтеза 1,2,4-триазолов, наиболее важные из которых основаны на создании и циклизации структур типа N—С—N—N—С и С—N—С—N—N. В качестве примера первого типа можно привести термическую конденсацию ацилгидразида с амидом или (что лучше) с тиоамидом (реакция Пеллиццари); так, бензоилгидразид вступает в реакцию с тиобенза-мидом при 140 °С с образованием 3,5-дифенил-1,2,4-триазола (15). Примером второго типа циклизации служит реакция Эйнхорна — Бруннера, в которой гидразин или монозамещенный гидразин конденсируется с диациламином в присутствии слабой кислоты. Так, при взаимодействии фенилгидразина и N-формальбензамида образуется с хорошим выходом 1,5-дифенил-1,2,4-триазол (16).

1Н-1,2,3-Триазолы могут быть получены 1,3-диполярным присоединением разнообразных ароматических азидов XN3 (X = алкил, винил, арил, ацил, арилсульфонил и т. д.) к ацетиленам. Некоторые соединения (енолят-анионы, простые эфиры енолов, енамины, а-ацил-фосфорилиды) при взаимодействии с азидами дают 1,2,3-триазолы. Например, илид 17 реагирует с азидобензолом в растворе при температуре 80 °С с образованием 1,5-дифенил-1,2,3-триазола с хорошим выходом. Эти реакции, в противоположность присоединению к ацетиленам, высоко региоселективны. Иногда при присоединении азидов (например, триметилсилил- или ацилазидов) образуются 2Н-1,2,3-триазолы; при этом, очевидно, миграция заместителя к атому N-2 происходит после замыкания цикла. Наиболее часто 2Н-1,2,3-триазолы получают из 1,2-дикетонов. Примером реакции такого типа может служить окислительная циклизация в присутствии солей меди(Н) бис-арилгидразонов 1,2-дикетонов. Возможный механизм циклизации бис-фенилгндразонов а-кетоальдегидов 18 приведен ниже.

Некоторые распространенные методы получения тетразолов заключаются в присоединении азотистоводородной кислоты (Н3N) или азид-ионов к соединениям, содержащим кратную связь углерод — азот. Примерами таких реакций могут служить:
а) синтез 5-фенилтетразола нагреванием бензонитрила и азида натрия в N,N-диметилформамиде,
б) образование 1-бензилтетразола из бензилизонитрила и азотистоводородной кислоты в присутствии следовых количеств серной кислоты
в) превращение имидоил-хлоридов 19 в 1,5-дизамещеиные тетразолы взаимодействием с НЫз или азидом натрия. 2,5-Дизамещенные тетразолы могут быть получены другим способом — реакцией амидразонов 20 с азотистой кислотой.


2.3. Свойства пиразолов
2.3.1. Реакции замещения
Химические свойства этих азолов отличаются от свойств пиррола тем значительнее, чем больше число атомов азота в молекуле. Для этих циклических систем относительно редки реакции злектро-фильного замещения по атому углерода, так как атомов углерода в молекуле меньше, и злектрофилы преимущественно атакуют атомы азота. Пиразолы можно хлорировать и бромировать в мягких условиях по положению 4. 4-Нитропиразол можно получить непрямым синтезом из пиразола: при взаимодействии с ацетатом нитро-ния (N02 "tAc- ) образуется 1-нитропиразол (21), который при обработке серной кислотой превращается в 4-нитропиразол. Эта реакция, по-видимому, протекает с переносом группы N02 + через стадию образования промежуточного катиона 22, так как было показано, что 1-нитропиразол можно использовать как удобный и эффективный нитрующий агент для ароматических углеводородов в присутствии кислот. 1,2,3-Триазол может быть превращен в 4,5-дибромопроизводное реакцией с гипобромитом натрия в уксусной кислоте, а 1,2,4-триазол можно прохлорировать по положению 3, причем реакция идет через образование 1-хлоропроизводиого, которое может быть выделено. Таким образом, для этих циклических систем возможно электрофильное замещение по атому углерода, но процесс идет через образование интермедиата, получаемого в результате первоначальной атаки электрофилом атома азота.

Азолы могут быть проалкилированы по атому азота с помощью разнообразных алкилирующих агентов, но часто бывает трудно предсказать, какой из возможных изомеров образуется. Со- отношение изомеров обычно в значительной степени зависит oт природы алкилирующего агента и условий проведения реакции. На пример, метиловый эфир 5-метилпиразол-З-карбоновой кислоть (23) метилируется диазометаном по атому N-1, а метилиодидом — по атому N-2. Иногда на образование тех или иных соединение оказывают влияние пространственные факторы: например, 4-фенил 1,2,3-триазол метилируется диметилсульфатом по атомам N-1 iN-2, а не N-3. Некоторые N-триметилсилилазолы можно про алкилировать селективно; например, 1-триметилсилил-1,2,4-триазо; (24), который легко получить из 1,2,4-триазола, алкилируется по положению 2. Триметилсилильная группа в ходе реакции отщепляется.

Существует много примеров кватернизации N-замещенных азолов при взаимодействии с алкилирующими агентами. Можно получить даже дичетвертичные соли: например, 1 -метил-1,2,4-триазол успешно метилируется по атомам N-4 и N-2 в избытке тетрафторобората триметилоксония, а соль 25 может быть выделена в виде твердого кристаллического вещества.

Некоторые азолы вступают в реакции нуклеофильного замещения в случае, если заместители у атомов углерода представляют собой хорошие уходящие группы. 5-Бромо- или 5-хлоро-1-замещенныететразолы могут быть превращены в другие 5-замещенные соединения взаимодействием с нуклеофилами. 1,5-Дизамещенные тетразолы реагируют легче, чем их 2,5-изомеры, вероятно, из-за того, что образующиеся интермедиаты более стабильны.

Рис. 1. Реакции нуклеофильного замещения 5-6ромо-1-метилтетразола и 5-бромо-2-метилтетразола.
Катализируемая основаниями реакция 5-хлоро-1-фенилтетразола с фенолами приводит к образованию эфиров 26, которые могут затем подвергаться восстановительному расщеплению при взаимодействии с водородом над палладиевым катализатором, что служит хорошим методом дезоксигенировния фенолов.

Замещение галогенов в этих азолах значительно облегчается при наличии дополнительных электроноакцепторных заместителей при атомах углерода или кватернизацией атома азота; например, в катионе триазолия 27 хлор легко замещается азид-ионами.

2.3.2. Реакции, приводящие к раскрытию цикла
Азолы обычно с трудом подвергаются раскрытию цикла. Эти соединения устойчивы к окислительному расщеплению и не раскрываются под действием большинства восстановителей. При взаимодействии 1,5-дизамещенных тетразолов с алюмогидридом лития образуются амины 28.

Некоторые 1,2,3-триазолы и тетразолы достаточно легко раскрываются при нагревании. Кольчато-цепиая таутомерия довольно обычна для 1,5-дизамещенных 1Н-тетразолов (рис. 2,а), а также наблюдается, но реже, для 1-замещенных 1,2,3-триазолов (рис. 2, б). Раскрытие цикла облегчается наличием электроноак-цепторных групп в положении 1; например, 1-циано-1,2,3-триазол, в противоположность большинству 1,2,3-триазолов, существует в растворе в равновесии с его диазоиминной таутомерной формой.
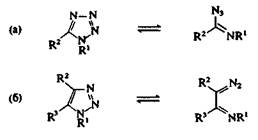
Рис. 2. Кольчато-цепная таутомерия тетразолов и 1,2,3-триазолов.
Цепные таутомеры обратимо циклизуются, но в зависимости от природы заместителей и условий реакции они могут перегруппировываться и подвергаться другим реакциям, в ходе которых происходит отщепление азота. При нагревании тетразолов и 1,2,3-триазолов, имеющих аминогруппу в положении 5, происходит пере группировка Димрота . Эта реакция проиллюстрирована для 5-амино-1 -фенил-1,2,3-триазолов на рис. 3. Положение равновесия таких перегруппировок зависит от природы заместителей и от рН растворителя.
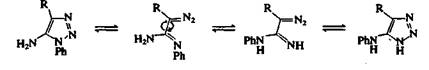
Рис. 3. Перегруппировка Димрота.
При нагревании и облучении тетразолов и 1,2,3-триазолов происходит отщепление азота. Фотолизом или термолизом 2,5-дизамещенных тетразолов получают нитрилимиды, которые затем могут вступать в реакции 1,3-диполярного циклоприсоединения или 1,5-электроциклизации в зависимости от природы заместителей. При фотолизе 1,5-дизамещенных тетразолов получают соединения, образование которых, по-видимому, идет через имидоилиитреновый интермедиат: например, 1,5-дифенилтетразол превращается в 2-фенилбензимида-зол (29). Выше был приведен другой пример синтеза имидазола.
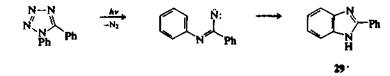
Аналогичным образом при термолизе или фотолизе 1-замещенных 1,2,3-триазолов образуются соединения, которые могут быть получены из имидоилкарбеновых интермедиатов. Направление процесса в значительной степени зависит от природы заместителей и условий реакции, но существует надежное подтверждение того, что некоторые продукты пирролиза 1,2,3-триазолов в газовой фазе образуются через короткоживущие 1 Н-азириновые интермедиаты 30.
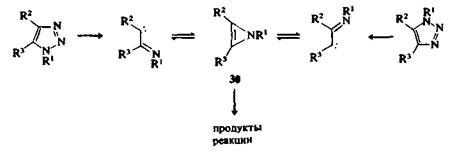
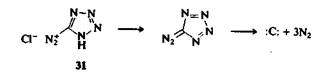
Возможно наиболее замечательным применением реакций, идущих с отщеплением азота, можно назвать использование хлорида тетразол-5-диазония (31) в качестве источников атома углерода. Соль 31 осторожно разлагают нагреванием в присутствии реагентов, которые могут захватывать образующийся моноатомный углерод.
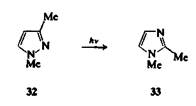
При нагревании и облучении 1Н-пиразолов и 1,2,4-триазолов, в которых отсутствует группа -N=N—, редко происходит раскрытие цикла. Некоторые пиразолы подвергаются фотоперегруппировке в имидазолы (аналогично фотохимическим перегруппировкам фуранов и тиофенов). Например, 1,3-диметилпиразол (32) при облучении превращается в 1,2-диметилимидазол (33)