Реферат: Бензойная кислота
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Сульфосалициловая кислота
2-Окси-5-сульфобензойная кислота
HO3S(HO)C6H3COOH ·2H2O M 254,22
Описание
Сульфосалициловая кислота представляет собой бесцветные полупрозрачные кристаллы игольчатой формы или белый кристаллический порошок.
Сульфосалициловая кислота легко растворима в воде, спирте и эфире, нерастворима в бензоле и хлороформе, светочувствительна. Водные растворы имеют кислую реакцию.
Применение
Сульфосалициловая кислота применяется в медицине для качественного определения белка в моче, при проведении аналитических работ для определения содержания нитратов в воде.
В промышленности сульфосалициловая кислота используется в качестве добавок к основному сырью, при синтезе веществ.
Физические свойства и нахождение в природе
Монокарбоновые кислоты ряда бензола — бесцветные кристаллические вещества с температурой плавления выше 100 °С. Кислоты с пара- положением заместителей плавятся при значительно более высоких температурах, чем их изомеры. Ароматические кислоты кипят при несколько более высоких и плавятся при значительно более высоких температурах, чем кислоты жирного ряда с тем же числом углеродных атомов. Монокарбоновые кислоты довольно плохо растворяются в холодной воде и значительно лучше в горячей. Низшие кислоты летучи с парами воды. В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: константа диссоциации бензойной кислоты 6,6·10-5 , уксусной кислоты 1,8·10-5 . При 370С она разлагается до бензола и СО2 (в небольшом количестве образуются фенол и СО). При взаимодействии с бензоилхлоридом при повышенных температурах бензойная кислота превращается в бензойный ангидрид. Бензойная кислота и ее эфиры содержатся в эфирных маслах (например, в гвоздичном, толуанском и перуанском бальзамах, бензойной смоле). Производное бензойной кислоты и глицина – гиппуровая кислота – продукт жизнедеятельности животных.Кристаллизуется в виде бесцветных пластинок или игл, плавящихся при 121 оС, легко растворимых в спирте и эфире, но трудно растворимых в воде. В настоящее время бензойная кислота довольно широко применяется в промышленности красителей. Бензойная кислота обладает антисентическими свойствами и поэтому используется для консервирования пищевых продуктов. Значительное применение находят также различные производные бензойной кислоты.
Химические свойства
Бензол был открыт Фарадеем в 1825 г. и была установлена его брутто-формула-С6 Н6 . В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5. Этой формулой пользуются и в настоящее время, хотя она, как позднее будет показано, несовершенна - не отвечает полностью свойствам бензола.
Наиболее характерной особенностью химического поведениябензола является удивительная инертность двойных углерод-углеродных связей в его молекуле: в отличие от рассмотренных; ранее непредельных соединений он устойчив к действию окислителей (например, перманганата калия в кислой и щелочной среде, хромового ангидрида в уксусной кислоте) и не вступает в обычные реакции электрофильного присоединения, характерные для алкенов, алкадиенов и алкинов.
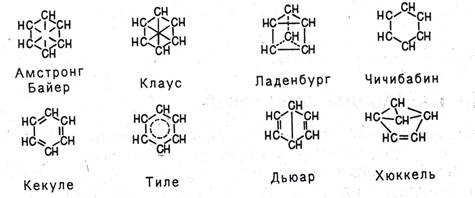
Пытаясь объяснить свойства бензола особенностями строения, многие ученые вслед за Кекуле выдвигали по этому поводу свои гипотезы. Поскольку непредельность бензола явно не проявлялась, считали, что двойных связей в молекуле бензола нет. Так, Армстронг и Байер, а также Клаус предположили, что в молекуле бензола четвертые валентности всех шести атомов углерода направлены к центру и насыщают друг друга, Ладенбург - что углеродный скелет бензола представляет собой призму, Чичибабин - что в бензоле углерод трехвалентен.
Тиле, усовершенствуя формулу Кекуле, утверждал, что двойные связи в последнем не фиксированы, а постоянно перемещаются-«осциллируют», а Дьюар и Хюккель предложили структурные формулы бензола с двойными связями и малыми циклами.
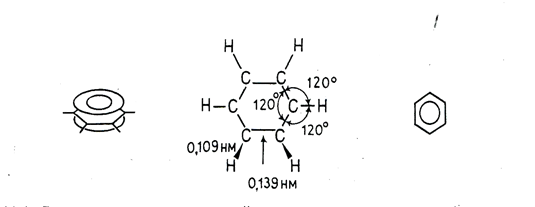
В настоящее время на основании данных многочисленных исследований можно считать твердо установленным, что шесть углеродных и шесть водородных атомов в молекуле бензола находятся в одной плоскости и что облака π-электронов атомов углерода перпендикулярны плоскости молекулы и, следовательно, параллельны друг другу и взаимодействуют между собой. Облако каждого π-электрона перекрывается облаками π-электронов соседних углеродных атомов. Реальная молекула бензола с равномерным распределением π-электронной плотности по всему кольцу может быть представлена в виде плоского шестиугольника, лежащего между двумя торами.
Отсюда следует, что формулу бензола логично изображать в виде правильного шестиугольника с кольцом внутри, подчеркивая тем самым полную делокализованность π-электронов в бензольном кольце и равноценность всех углерод-углеродных связей в нем. Справедливость последнего заключения подтверждена, в частности, результатами измерения длин С—С-связей в молекуле бензола; они одинаковы и равны 0,139 нм (С—С-связи в бензольном кольце короче ординарных (3,154 нм), но длиннее двойных (0,132 нм)). Распределение электронной плотности в молекуле бензола; длины связей, валентные углы
Очень важным производным бензойной кислоты является ее хлорангидрид — хлористый бензоил. Это жидкость с характерным запахом и сильным лакриматорным действием. Используется как бензоилирующий агент.
Пероксид бензоила используется как инициатор для реакций полимеризации, а также как отбеливающий агент для пищевых масел, жиров, муки.
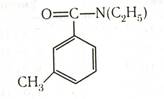
Толуиловые кислоты. Метилбензойные кислоты называют толуиловыми кислотами. Они образуются при частичном окислении о-, м- и п -ксилолов. NN-Диэтил-м -толуилмид является эффективным репеллентом — препаратом, отпугивающим насекомых:
п-трет -Бутилбензойную кислоту получают в промышленных масштабах жидкофазным окислением трет -бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
Фенилуксусную кислоту получают из хлористого бензила через нитрил или через магнийорганические соединения. Это кристаллическое вещество с т. пл. 76 °С. Благодаря подвижности подородных атомов метиловой группы легко вступает в реакции конденсации. Эта кислота и ее эфиры применяются в парфюмерии.
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда. Реакциями с участием карбоксильной группы получают различные производные кислот. Соли получают действием кислот на карбонаты или щелочи. Эфиры — нагреванием смеси кислоты и спирта в присутствии минеральной (обычно серной) кислоты: