Реферат: Электросинтез хлорной кислоты
4.ПРОИЗВОДСТВО ХЛОРНОЙ КИСЛОТЫ .РЕАКЦИИ НА ЭЛЕКТРОДАХ И УСЛОВИЯ ЭЛЕКТРОЛИЗА.
При электролизе водных растворов соляной кислоты на аноде возможно выделение элементарного хлора или кислорода, а на электродах с высоким анодным потенциалом — также образование высших кислородных соединений хлора — хлорной кислоты. В зависимости от условий проведения процесса и прежде всего от концентрации ионов С1- , температуры и применяемого анодного материала, скорости этих трех процессов могут очень сильно изменяться.
При электролизе концентрированной соляной кислоты на анодах всех видов, стойких в этих условиях, происходит выделение элементарного хлора с выходом по току, близким к 100%. По мере снижения концентрации соляной кислоты выход хлора по току уменьшается за счет увеличения скорости выделения кислорода на аноде, а при применении графитовых анодов и за счет окисления графита. Образование хлорной кислоты наблюдается только в сильно разбавленных растворах НС1. При электролизе 1 н. раствора на платиновых анодах соляная кислота расходуется практически нацело на получение хлора, а образование хлорной кислоты идет в очень малой степени. При снижении концентрации соляной кислоты до 0,1 н. примерно 50% НС1 расходуется на образование хлорной кислоты и 50% — на получение газообразного хлора.
Окисление ионов хлора до хлорной кислоты протекает при высоком положительном потенциале 2,8—3,0 В. На графитовом аноде в водных растворах хлоридов невозможно достичь такого потенциала, поэтому на этих анодах образование хлорной кислоты не наблюдается даже в сильно разбавленных растворах.
УСЛОВИЯ ЭЛЕКТРОЛИЗА.
Процесс электрохимического синтеза хлорной кислоты на аноде описывается следующим суммарным уравнением:
НСL + 4Н2 О – 8e - -- НСLO4 + 8H + (1)
На катоде происходит выделение водорода.
В процессе электролиза растворов хлороводородной кислоты на аноде возможно образование хлора, кислорода и хлорной кислоты. В зависимости от условий проведения электролиза, таких как концентрация ионов хлорида, температура и применяемый анодный материал, скорость образования этих трех веществ в значительной степени может изменяться. Образование хлорной кислоты наблюдается только в разбавленных растворах хлороводородной кислоты.
Для получения хлорной кислоты необходимо применять аноды, на которых можно добиться высокого перенапряжения для процессов, конкурирующих с окислением хлор-иона до иона С104 - т.е. для процессов выделения хлора и кислорода. В рассматриваемом случае это достигается на платиновых или платино-титановых анодах при низкой концентрации хлор-ионов и низкой температуре электролиза. При этом, естественно, получают хлорную кислоту низкой концентрации. Из-за малой электропроводности электролита напряжение на ячейке и расход электроэнергии велики.
При электролизе 0,5 н. раствора соляной кислоты получена хлорная кислота концентрацией до 20 г/л. При невысокой плотности тока и температуре 18 °С напряжение на ячейке составляло 8 В, а расход электроэнергии около 47кВт.ч/кг 100%-ной хлорной кислоты. Недостатки такого способа заключаются в большом расходе электроэнергии и низкой концентрации получаемой хлорной кислоты.
Для снижения удельного электрического сопротивления электролита и соответственно потерь напряжения в электролите электролизу подвергают разбавленные растворы соляной кислоты в растворах сильных электролитов. Наиболее удобно вести процесс окисления иона С1- до СLO4 - в растворах хлористого водорода или хлора в концентрированной 4—6 н. хлорной кислоте. При этом возможна организация непрерывной подачи хлористого водорода, соляной кислоты или хлора в электролит и отвода части электролита в виде концентрированной хлорной кислоты для окончательной переработки ее в готовую продукцию .
Протекание процесса электролиза зависит от потенциала анода, концентрации хлорной и соляной кислот в электролите, температуры электролиза и плотности тока .
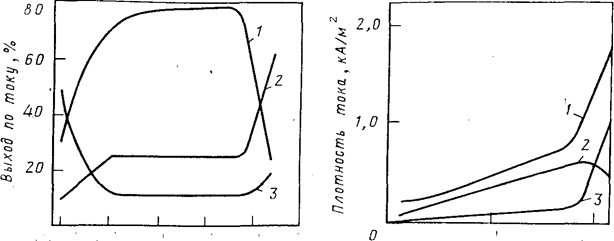
При изменении концентрации НС1 в электролите при прочих равных условиях изменяется как плотность суммарного тока, так и плотность парциальных токов, расходуемых на образование СLO4 - и другие процессы, протекающие одновременно на аноде. На рис. 2 показана зависимость плотности общего и парциальных токов получения СLO4 - и СL2 от концентрации соляной кислоты в электролите при проведении электролиза при температуре —20 °С. С повышением температуры электролиза резкое увеличение плотности тока выделенияСL2 и снижение плотности тока образования СLO4 - наступает при более низкой концентрации НС1 в электролите.
Концентрация НСL,кмоль/м3 Концентрация НСL,кмоль/м3
Рис.2. Зависимость выхода по току различных продуктов электролиза от концентрации хлороводородной кислоты в 4 н. растворе хлорной кислоты при температуре —20 °С: 1 — НСLO4 ; 2 — С12 ; 3—О2 | Рис. 3. Зависимость плотности тока, расходуемой на образование СLO4 и СL2 , а также общей плотности тока от концентрации НСL в электролите (4 н. раствор НСLO4 ) при температуре —20°С: 1 —общий ток; 2— ток на образование СLO4 -; 3— ток на выделение СL2 |
С изменением концентрации НС1 в электролите меняется соотношение парциальных токов, расходуемых на образование СLO4 - и выделение СL2 и O2 . На рис. 3 приведена зависимость выхода по току продуктов электролиза от концентрации соляной кислоты в электролите. Данные получены при 20 °С в 4 н. НСLO4 на платиновых анодах с потенциалом 2,8 В
Наиболее высокие значения выходов хлорной кислоты по току получены для соляной кислоты концентрацией 0,8—2 н. При снижении концентрации соляной кислоты ниже 0,8 н. выход НСLO4 по току уменьшается за счет увеличения выхода кислорода по току. При повышении концентрации НС1 более 2 н. возрастает расход тока на выделение хлора, и выход по току хлорной кислоты также резко снижается. Оптимальная концентрация соляной кислоты в электролите увеличивается при снижении температуры электролиза и зависит от концентрации хлорной кислоты в электролите.
Процесс анодного окисления соляной кислоты в хлорную сильно зависит от температуры. На рис. 4 приведена зависимость выхода по току продуктов электролиза от температуры раствора при содержании в электролите 4 н. НСLO4 и 1 н. НС1 и значении потенциала анода 2,8—3,0 В. С понижением температуры выход хлорной кислоты по току возрастает, а хлора и кислорода соответственно снижается.
Содержание примесей в хлорной кислоте зависит от чистоты исходной соляной кислоты и применения достаточно стойких к коррозии конструкционных материалов для изготовления электролизеров, трубопроводов и аппаратуры. В отбираемой из электролизера хлорной кислоте содержится значительное количество ионов хлора. Для получения товарной кислоты необходима ее очистка от ионов хлора, которую осуществляют электрохимическим способом, т.е. возможно более полным окислением ионов хлора до хлорной кислоты. Однако при этом по мере снижения концентрации ионов хлора выход хлорной кислоты по току снижается и приближается к нулю при достаточно полной очистке раствора от примесей соляной кислоты. С увеличением степени очистки хлорной кислоты от ионов хлора снижается общий выход по току, возрастают расход электрической энергии и скорость коррозии платиновых анодов.
Температура., °С Рис. 4. Зависимость выхода по току различных продуктов электролиза 1 н. раствора НС1 в 4 н. НСLO4 от температуры: 1— НСLO4 ; 2—С12 ; 3— O2 , |
При очень высоких требованиях к чистоте хлорной кислоты последнюю можно дополнительно очищать от примесей НС1 отгонкой или отдувкой соляной кислоты инертным газом. Для очистки хлорной кислоты, получаемой из электролизеров продукционной стадии, от соляной кислоты можно применять также ректификацию. При этом отпадают трудности, связанные с электрохимической очисткой, и достигается более высокий суммарный выход хлорной кислоты по току. Хлористый водород, отгоняемый из хлорной кислоты при ректификации, можно вновь возвратить на стадию продукционного электролиза.
Хлорную кислоту можно получать также анодным окислением хлора, растворенного в электролите — в 4—6 н. растворе хлорной кислоты . При электролизе таких растворов на платиновых анодах и серебряных катодах электролизеры, рассчитанные на нагрузку 3,5 кА при плотности тока 2 кА/м2 и температуре О °С, работали при напряжении 4 В. Процесс описывается суммарным выражением
СL2 + 8Н2 0 — 2 НСLO4 + 7 Н2 (2)
По этому методу может быть получена очень чистая кислота, поскольку со стороны не вводятся никакие загрязняющие примеси. Часть электролита отбирают и после перегонки получают 60—70%-ную товарную кислоту.
Для электрохимического получения хлорной кислоты применяют электролизеры с платиновыми или платино-титановыми анодами . Вследствие очень высокой коррозионной активности смесей хлорной и соляной кислоты в качестве катода часто применяют графит. Графитовые катоды легко выдерживают остановки, связанные со снятием катодной поляризации. Известно, что при анодной поляризации платины в не сильно разбавленных растворах соляной кислоты при потенциалах отрицательнее 1,1—1,2 В (против н. в. э) происходит анодное растворение платины с выходом по току, близким к 100%. В этих условиях скорость растворения платины увеличивается с ростом потенциала, кислотности раствора и температуры. При потенциале платины (в анодную сторону) выше 1,1—1,2В наблюдается пассивация платины и при потенциале 1,3В в 1 н. НС1 скорость растворения платины снижается до 4•10-5 A/м2
Пассивация поверхности платинового анода, наблюдаемая в процессе электрохимического получения хлорной кислоты, связана с образованием на поверхности слоев адсорбированного кислорода и фазовых оксидов различного состава. Структура оксидных слоев на поверхности платины и ее коррозионная стойкость зависят от соотношения концентраций НС104 ,и НС1 в электролите. В процессе электролиза соляной кислоты с целью получения хлора и водорода добавление к электролиту 50—150 г/л хлорной кислоты снижает скорость анодного растворения платины. При электролизе чистых растворов НС104 кислород связан с поверхностью платины более прочно, чем при электролизе смесей НС104 и НС1
На рис. 5 приведена зависимость плотности общего тока поляризации на платиновом аноде и плотности тока растворения платины от потенциала анода при электролизе 3 н. НС104 при различных температурах .
С увеличением содержания НС1 в электролите количество фазовых оксидов на поверхности анода уменьшается. В процессе электролиза смесей НС104 и НС1 при высоких анодных потенциалах и постоянной суммарной кислотности увеличение содержания НС1 в электролите или растворение элементарного хлора приводит к повышению коррозионной стойкости платинового анода . Как при комнатной, так и при пониженной температуре, увеличение содержания НС1 в электролите или насыщение его элементарным хлором приводит к снижению плотности тока растворения платины. Результаты исследований, проведенных при температурах —15 и —25 °С и потенциале 2,8В (н.в.э.), приведены на рис. 6.
На рис. 7 приведена зависимость доли тока, расходуемого на растворение платины, от концентрации НС1 в электролите или от насыщения электролита хлором для тех же условий электролиза.