Реферат: Нокаут генов
Однако основной причиной использования мыши в качестве модели для инактивации гена является возможность изолирования эмбриональных стволовых клеток, в которых любой ген может быть модифицирован [29]. Клеточные линии, содержащие модифицированный ген, могут быть привнесены в развивающийся зародыш, что позволяет получить химерное животное, несущее искусственно созданную мутацию (рис. 1).
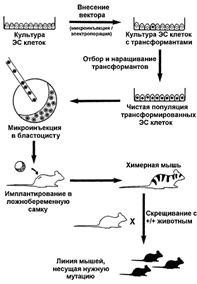
Рис. 1. Стратегия получения линии нокаутированных мышей [5].
Молекулярно-генетическим механизмом, позволяющим осуществлять инактивацию гена, является гомологичная рекомбинация между экзогенной ДНК, несущей задуманные исследователем изменения, и геномной ДНК объекта.
Классическая схема получения нокаутированных мышей включает несколько этапов: получение векторной конструкции, с последующим внесением ее в культуру эмбриональных стволовых клеток (ЭСК) и отбор трансформантов. Трансформированные ЭСК вносят в зародыш, и полученных химерных животных скрещивают для получения линии мышей, гомозиготных по полученной мутации (см. рис. 1).
1.1 Особенности векторных конструкций
В зависимости от поставленной задачи используются два типа векторов: замещающий и вставочный. Первый тип векторов позволяет заменить участок гена мишени, в то время как второй интегрирует в изучаемую последовательность. Строение обоих типов векторов одинаково, кроме ориентации фланкирующих последовательностей (рис. 2). Наиболее часто используются замещающие вектора.
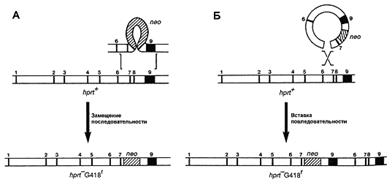
Рис. 2. Два типа векторов – замещающий (А) и вставочный (Б) – и их механизмы интеграции в геном [5].
Вектор для трансформации несет клонированную последовательность изучаемого гена, с внесенными в нее необходимыми изменениями. Это может быть: внесение стоп-кодона, приводящее к синтезу короткого неактивного пептида; делеция одного или нескольких экзонов; делеция промоторной области; вставка, приводящая к нарушению нормального функционирования гена и любые другие изменения, приводящие к отсутствию функционального продукта изучаемого гена или значительно снижающие его активность. Также в эту последовательность вносится положительный селективный маркер (МПС), которым является ген neo. Продукт этого гена дает несущим его клеткам устойчивость к антибиотикам неомицину и канамицину. Модифицированная последовательность должна быть фланкирована неизмененными участками, по которым будет проходить рекомбинация. Эффективность рекомбинации зависит от длины фланкирующих последовательностей [22], что в свою очередь зависит от возможностей вектора (рис. 3). При длине гомологичного плеча около 5 тыс. п.н. процент рекомбинации составляет 0,001.
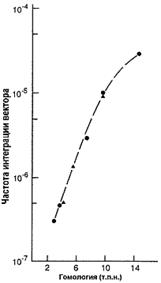
Рис. 3. Зависимость частоты интеграции вектора от длины гомологичных плеч [22].
В качестве вектора можно использовать бактериальные искусственные хромосомы (BAC), со вставками фрагментов генома мыши. В этом случае размер одного плеча может составлять до 150 тыс. п.н., а размер делеции до 25 тыс. п.н. Наилучший процент рекомбинации (8,3%) получен авторами с использованием длины плеча 110 тыс. п.н. [26].
Существует вероятность, что рекомбинация пройдет не по исследуемым нами участкам генома, а в любой другой сходной области. При этом ген neo (МПС) сохранится, и в отобранном пуле ЭСК будут присутствовать рекомбинантные клетки, не несущие необходимых изменений. Эта проблема решается внесением в векторную конструкцию маркера отрицательной селекции (МОС). Им может служить ген тимидин-киназы простого вируса герпеса (HSV-tk) или ген дифтерийного токсина А (DT-A), продукты которых убивают эукариотические клетки. Положение МОС с наружной стороны гомологичного плеча вектора позволяет элиминировать его после прохождения гомологичной рекомбинации (рис. 4). В случае же негомологичной рекомбинации, МОС оказывается интегрированным в геном трансформированной клетки, что приводит к ее элиминации. Наличие двух маркеров селекции (положительного и отрицательного) позволяет быстро и эффективно проводить отбор нужных трансформантов [23,19].
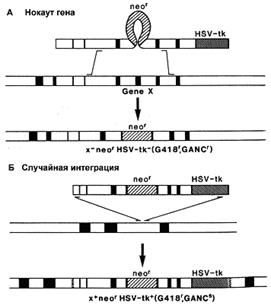
Рис. 4. Действие системы позитивной – негативной селекции: А) интеграция вектора в нужный участок генома, приводящая к нокауту гена, Б) случайная интеграция (синтез тимидин-киназы и гибель клеток) [19].
1.2 Внесение вектора в эмбриональные стволовые клетки
Для трансформации используют эмбриональные стволовые клетки мышей. Помимо того, что культура ЭС клеток способна расти in vitro, при пересадке во взрослую мышь или эмбрион клетки имеют свойство приживаться. ЭС клетки, в отличие от специализированных соматических клеток, сохраняют генетические потенции без тканевой специализации. Эти клетки имеют "минимальный" фенотип: минимум рецепторов и программ для взаимодействия с микроокружением, поскольку лишь 5% из 500 генов транссигнализации экспрессировано в пролиферирующих ЭСК. Второй важнейшей характеристикой ЭСК в культуре является практически неограниченный потенциал пролиферации, обусловленный особенностями фенотипа незрелых клеток. Третьей особенностью ЭСК является рост суспензионными клонами без какой-либо примеси продвинутых клеток, прикрепленных к подложке. Каждый клон в такой культуре является производным одной прародительской ЭСК [1].
Эмбриональные стволовые клетки мыши впервые получены в 1981 году [8], что дало возможность для развития работ по инактивации генов. Внесение линеализированного вектора в ЭС клетки возможно несколькими методами: микроинъекция, трансфекция (электропорация), трансдукция (вирусная инфекция). Перечисленные методы имеют свои преимущества и недостатки.
Микроинъекция позволяет с частотой до 100 процентов вносить экзогенную ДНК в клетку, а частота гомологичной рекомбинации составляет около 0,67%. Этот метод, несомненно, является наиболее эффективным. Однако для осуществления микроинъекции требуется дорогое оборудование и высокая квалификация экспериментатора. Помимо этого, сам метод очень трудоемок и занимает много времени. Векторные конструкции микроинъекцией можно вносить и в зиготу, но отобрать нужные трансформанты в этом случае невозможно.
Наиболее экономичными и достаточно эффективными методами внесения экзогенной ДНК в клетку являются электропорация и ретровирусная инфекция. К их достоинствам, в первую очередь, следует отнести возможность одноразово обработать сотни тысяч клеток, которые благодаря системе позитивной-негативной селекции достаточно быстро проходят отбор. Это существенно упрощает и делает экономически выгодным, по сравнению с микроинъекцией, процедуру получения трансформированных клеток. Оба метода имеют свои недостатки: больший процент негомологичной рекомбинации при внесении векторных систем электропорацией по сравнению с другими методами, ограниченые размеры ретровирусных векторов и т.д. [21]. Наиболее часто внесение векторов в клетку проводят с помощью электропорации. В то же время ретровирусная инфекция позволяет вносить экзогенную ДНК не только в ЭС клетки, но и в эмбрионы. Итак, линия трансформированных клеток получена и поддерживается. Следующий этап – внесение клеток в эмбрион мыши (как правило, на стадии бластулы). Химерный зародыш подсаживают в матку ложно беременной самки. Полученную таким образом химеру скрещивают с нормальным, но имеющим отличия (например, цвет) животным. Если полученные в первом поколении мыши имеют фенотип линии, из которой получены ЭС клетки, то их можно использовать для насыщающего скрещивания. Результатом будет получение линии животных, гомозиготных по созданной мутации.
2. Роль метилирования ДНК в контроле генома
Одним из способов видоизменения гена является его замена на бессмысленную последовательность ДНК — тогда ген "выключается". Исследователи систематически "выключают" гены и наблюдают, к каким последствиям на уровне организма приводит это "выключение". Такая методика называется "генетический нокаут" (gene knockout).
Она позволяет подробно изучить функцию конкретного гена во время эмбрионального развития и после рождения животного. Можно проследить, как каждый ген влияет на развитие организма и возникновение той или иной патологии. В связи с этим, метод ещё получил название "генетическое планирование". К настоящему моменту уже проведены опыты по "выключению" десяти тысяч генов мыши, это половина всего мышиного генома.
Для развития организма достаточно одной клетки с единичной (конечно же, диплоидной) копией ДНК, которая при делении точно воспроизводится от клетки к клетке. Это относится практически ко всем живым многоклеточным существам. У человека все его клетки содержат идентичную ДНК. Клетки крови, печени, мозга, стволовые клетки - все они одинаковы по ДНК. Чем же определяется многообразие имеющихся у человека высокоспециализированных клеток и тканей? Это достигается за счет включения или выключения генов, ответственных за специализацию клетки. Именно механизмы контроля работы, или как принято говорить, экспрессии генов являются основной темой исследований нашей группы. Одним из таких механизмов является метилирование генов - ковалентное присоединение метильной группы в 5 положении пиримидинового кольца цитозина. ДНК, содержащая метилированные цитозины, является транскрипционно неактивной, и гены, располагающиеся вблизи метилированных районов, молчат.
Роль метилирования ДНК и механизм его негативного воздействия на работу генов в процессе жизнедеятельности позвоночных организмов (на моделях лягушки, мыши и клеточных линий человека).
Метилирование ДНК у позвоночных приобретает смысловую нагрузку в виде подавления транскрипции близлежащих генов двумя основными способами: (А) за счет прямого воздействия на ДНК, в составе которой метилированный цитозин ингибирует связывание транскрипционного фактора со своим участком, и (Б) за счет специфического связывания с метилированным районом специализированных метил-ДНК узнающих белков, которые, в свою очередь, привлекают сложные механизмы подавления транскрипции путем модификации близлежащих гистонов.
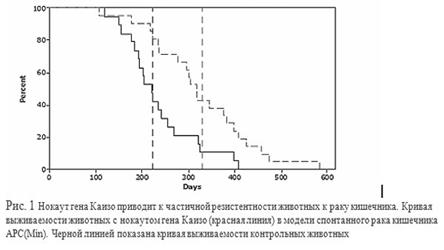
Как пример охарактеризован белок Каизо. Каизо, с одной стороны, связывается с катенином р120, а с другой - способен подавлять транскрипционную активность метилированных генов. Каизо имеет доменную структуру и состоит из N-концевого BTB/POZ домена и C-концевых цинковых пальцев типа C2H2. Цинковые пальцы специфично связывают 5-метил цитозин содержащую ДНК.