Реферат: Особенность химического состава природных вод. Внутренняя структура молекул воды. Физические сво
Al2 [Si2 O5 ](OH)4 + 6H+ = 2SiO2 + 5H2 O + 2Al3+
Основной источник железа - железосодержащие глины. Органические остатки (ниже обозначаются как "С"), находящиеся в контакте с ними, восстанавливают железо до двухвалентного, которое медленно вымывается в форме гидрокарбоната или солей гуминовых кислот:
2Fe2 O3 + "C" + 4H2 O + 7CO2 = 4Fe(HCO3 )2
Когда вода с растворёнными в ней ионами Fe2+ вступает в контакт с воздухом, железо быстро окисляется, образуя коричневый осадок гидроксида Fe(OH)3 . Со временем он превращается в болотную руду - бурый железняк (лимонит) FeO(OH). Карельская болотная руда использовалась в XVIII-XIX столетиях для получения железа.
Синеватая плёнка на поверхности воды - это Fe(OH)3 , образующийся, когда подземные воды, содержавшие ионы Fe2+ , вступают в контакт с воздухом. Ее часто путают с масляной пленкой, однако различить их очень легко: у пленки гидроксида железа рваные края. Если поверхность воды слегка взволновать, гидроксидная пленка, в отличие от масляной, не будет переливаться.
Микроэлементы
К этой группе относятся элементы, соединения которых встречаются в природных водах в очень малых концентрациях, поэтому их и называют микроэлементами. Их концентрация измеряется микрограммами в 1 л (мкг/л), а часто имеет и более малые значения. Микроэлементы представляют собой самую большую группу элементов химического состава природных вод, в нее входят все элементы периодической системы, не включенные в предыдущие группы рассмотренных компонентов. Условно их можно разделить на пять подгрупп: 1) типичные катионы (Li+ , Rb+ , Cs+ , Be2+ , Sr2+ , Ba2+ и др.); 2) ионы тяжелых металлов (Cu2+ , Ag+ , Au+ , Pb2+ , Fe2+ , Ni2+ , Co2+ и др); 3) амфотерные комплексообразователи (Cr, Mo, V, Mn); 4) типичные анионы (Br- , I- , F- ); 5) радиоактивные элементы. Микроэлементы необходимы для нормальной жизнедеятельности растений, животных и человека. Однако при повышенной концентрации многие микроэлементы вредны и даже ядовиты для живых организмов. Поэтому часто они становятся загрязняющими веществами и концентрация их контролируется. Успешное изучение микроэлементов затруднено не только их малым содержанием в природных водах, но и в сильнейшей мере неясностью формы их присутствия в растворе. Последнее не только осложняет выяснение закономерностей их миграции и режима но и создает трудности при химическом анализе. Например, многие тяжелые металлы мигрируют в больших концентрациях именно во взвешенном, а не в растворенном состоянии. Растворенные органические комплексы образуют большинство металлов, прежде всего двух- и трехвалентные металлы с гуминовыми и фульвокислотами. Концентрация закомплексованных металлов определяется прежде всего концентрацией органических кислот. В виде коллоидных соединений присутствуют многие гидроксиды металлов. Возможно, происходит адсорбция органических веществ на поверхности коллоидов, что придает им большую стабильность в растворе.
Структура жидкости
Применение термина "структура" для описания льда понятно, лед кристалл и, разумеется, обладает внутренней структурой. Но что такое структура жидкости? "Разве отсутствие структуры - текучесть - не является определяющим качеством жидкости?" - писал Бернал. Оказывается, жидкость обладает структурой, и не одной, а несколькими. Все дело во временном масштабе.
Если с какой-либо фиксированной молекулой воды связать систему координат, то для наблюдателя, находящегося в этой системе, структура воды будет зависеть от характерного масштаба времени, с которым он будет наблюдать молекулярную жизнь воды. У воды существуют два характерных временных параметра. Как и у всякого вещества, будь то жидкость или твердое тело, существует период колебаний отдельной молекулы τυ . Для воды эта величина составляет значение 10-13 с. В жидкости, кроме периода колебаний молекул около своего положения равновесия τυ , имеется еще одно характерное время - время "оседлой жизни" τD , т.е. среднее время существования данного локального окружения одной молекулы. Для воды τD ~ 10-11 с, т.е. прежде чем перескочить на новое место, молекула воды совершает 100 колебаний на одном месте.
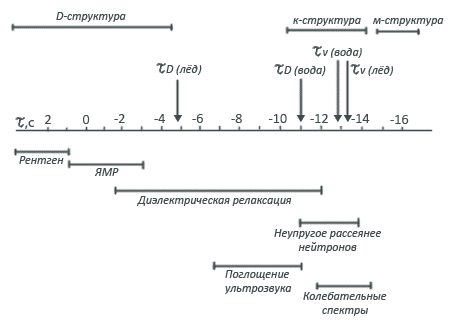
Два эти параметра разбивают временную шкалу на три области, каждой из которых соответствует своя структура жидкости. Если наблюдатель будет пользоваться достаточно малым временным масштабом, т.е. будет смотреть в течение времени, много меньшего τυ , то он увидит хаотически разбросанные молекулы, среди которых трудно усмотреть какой-либо порядок. Тем не менее это беспорядочное расположение молекул называют мгновенной, или М-структурой.
Чтобы понять, почему все-таки этот беспорядок называют структурой, наблюдателю необходимо перейти к более длительному временному масштабу. Но не слишком, точнее, больше чем τυ , но меньше чем τD . На этом временном интервале реальные молекулы уже не будут видны, наблюдатель сможет увидеть лишь точки, вокруг которых они совершают свои колебания. Оказывается, что эти точки в воде расположены довольно регулярно и образуют четкую структуру, называемую К-структурой, что означает "колебательно усредненная".
М- и К-структуры воды подобны таким же структурам льда. Чтобы увидеть различия этих структур у воды и льда, нужно понаблюдать за ними несколько дольше, т.е. с характерным временем, много большим чем τD . Наблюдаемую в этом случае картину называют Д-структурой - диффузионно усредненной. В отличие от льда Д-структура воды полностью размыта из-за частых перескоков молекул воды на большие расстояния (эти перескоки составляют процесс самодиффузии молекул воды). Д-структура образуется диффузионным усреднением К-структур и не может быть описана каким-либо особым расположением точек в пространстве. Сторонний наблюдатель видит, что, по сути дела, никакой Д-структуры жидкости и не существует (заметим, что именно Д-структура как полное статистическое усреднение ансамбля молекул определяет термодинамические свойства воды.).
И тем не менее Д-структура существует, и ее можно увидеть. Наблюдатель, находящийся на некоторой молекуле воды, увидит, что его собственная молекула, перемещается хаотически по всему объему воды, каждый раз оказывается в более или менее упорядоченном окружении. Он увидит, что чаще всего "его" молекулу будут окружать четыре других молекулы H2 O, иногда соседей окажется пять, иногда шесть, в среднем как мы знаем, их будет 4,4. Таким образом, Д-структурой воды можно считать картину, видимую наблюдателем.
Такой подход к описанию структуры воды чаще всего используется при интерпретации спектроскопических данных, потому что различные спектроскопические методы - рентгеновский, ЯМР, диэлектрическая релаксация, комбинационное рассеяние нейтронов - способны "считывать" молекулярные данные с различным характерным временем разрешения.
Перемещение молекул доказывается обычно броуновским движением. Каплю воды, в которой плавают очень легкие частицы твердого нерастворимого вещества, рассматривают под микроскопом и наблюдают, что частицы беспорядочно перемещаются в массе воды. Каждая такая частица состоит из множества молекул и не облачает самопроизвольным движением. Частицы испытывают удары со стороны движущихся молекул воды, которые заставляют их всё время менять направление движения, а это означает, что сами молекулы воды движутся беспорядочно.
Физические свойства
Вода обладает рядом необычных особенностей:
При таянии льда его плотность увеличивается (с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
Высокая температура и удельная теплота плавления (0 °C и 333,55 кДж/кг), температура кипения (100 °C) и удельная теплота парообразования (2250 КДж/кг [1]), по сравнению с соединениями водорода с похожим молекулярным весом.
Высокая теплоёмкость жидкой воды.
Низкая вязкость.
Высокое поверхностное натяжение.
Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Определенную роль играет протонное обменное взаимодействие между молекулами и внутри молекул воды. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °C этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Капля, ударяющаяся о поверхность воды
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде.[2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.