Реферат: Роль нервной системы в воспалительной реакции
Это имеет большое иммунобиологическое значение, так как определяет скорость разрушения бактерийных токсинов, чем предотвращается их вредящее действие на ткани. Такое же явление обнаружено и по отношению к другим, не менее важным в иммунологическом и физиологическом отношении ферментам — фосфатазе и дезаминазам.
При исследовании ферментов, расщепляющих фосфатиды, оказалось, что фосфатаза легких мышей действует быстрее, чем фосфатазы кролика и морской свинки (по отношению к моно- и диэстеразам).
Выявилась и другая важная особенность. Оказалось, что легкие морских свинок и мышей содержат довольно много лецитиназы (и фосфатазы), но активность этих ферментов у свинок угнетается присутствием даже небольших количеств жирных кислот туберкулезных палочек, что не наблюдается у мышей, эти энзимы легких кролика занимают промежуточное место. Легкие мышей, в отличие от легких морских свинок, содержат фермент, расщепляющий фосфатиды туберкулезных палочек, способствуя тем самым их разрушению.
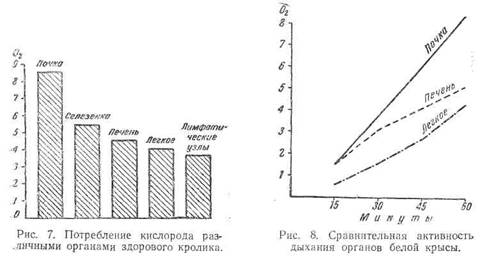
Весьма интересны данные, характеризующие с ферментативной стороны лимфатические узлы как ткань, на фоне которой начинается туберкулез. По ряду ферментативных показателей лимфатические узлы являются малоактивными, приближаясь к легким (Г. Е. Платонов). Видимо, этим и объясняется неполнота бактериолиза в них, что делает возможным длительное пребывание в них палочек и распространение инфекции. Так, по интенсивности окислительных процессов, приближаясь к легким, лимфатические узлы в 2—3 раза слабее, чем почки (органа с большей резистентностью к туберкулезу). Оказалась менее активной, чем в легких, и липаза, хотя можно было предполагать обратное, учитывая литературные данные о липолитической активности лимфоцитов, составляющих основную массу (до 70—90%) клеточного состава лимфатических узлов.
В связи с таким значением ферментативных процессов в сопротивляемости организма представляет значительный интерес исследование их в тканях во время воспалительной реакции при туберкулезе.
Ряд таких проведенных нами опытов по исследованию развития туберкулезной инфекции в легких и лимфатических узлах в динамике, начиная с первых часов, позволяет не только установить наличие значительных нарушений в них, но и выявить определенную закономерность фазовость этих изменений.
Первая фаза воспалительной реакции при туберкулезе характеризуется значительным угнетением ферментативных процессов. В морфологическом отношении она отличается в основном лимфоидным характером, что особенно ясно наблюдается в наших опытах по исследованию динамики развития реакции лимфатических узлов на туберкулезную инфекцию. Длительность этой фазы, как и последующих, вариирует в зависимости от ткани, токсических свойств туберкулезных бактерий и их количества. В это время особенно наблюдается снижение окислительных процессов и фосфатазы по сравнению с нормой, что начинается с первых часов инфекции и вызывается токсинами туберкулезных палочек и продуктами их распада. В лимфатических узлах через 2 дня после заражения распавшиеся туберкулезные палочки при окраске гематоксилин-эозином представлены в виде желтобурого пигмента — меланина. В легких явления разрушения туберкулезных палочек наблюдаются позже — на 8-й день и позже.
Однако лизис туберкулезных микобактерий не всегда приводит к их полному разрушению. При гибели клеток и накоплении продуктов рас пада, благоприятствующих их развитию, появляются вновь хорошо окрашивающиеся фуксином типичные туберкулезные микобактерий.
Угнетение дыхания в первую фазу реакции организма на инфекцию объясняется, как показали наши опыты, действием туберкулезных токсинов. Можно предполагать, что такое свойство туберкулезных токсинов является и причиной пролиферации соединительнотканных элементов, принимающих участие в образовании бугорка, как выражение компенсаторной реакции этой ткани на асфиксию, развивающуюся в участках ткани с осевшими туберкулезными микобактериями. Одновременно развивающийся высокий гликолиз при пониженных окислительных процессах в этой стадии развития бугорка способствует накоплению молочной кислоты в тканях — ацидозу.
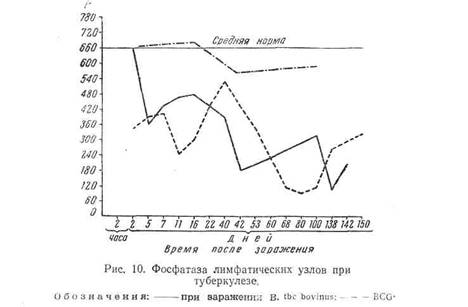
Асфиктическое и ацидотическое состояние в бугорке вызывают гибель фагоцитов и тканевых клеток, прилегающих к центрам формирующихся бугорков. Это подтверждается и рядом гистологических исследований, показывающих наличие дегенеративных изменений в фагоцитах уже на 3-й день (ядро утрачивает структуру, бледно красится и т. д.), С первых же дней заражения и до конца болезни снижается фосфатаза легких, особенно при вирулентном штамме (рис. 9).
Особенно значительное угнетение фосфатазы наблюдается в лимфа тических узлах средостения, начиная с первых же часов заражения кроликов и далее до конца — через 150 дней, когда наблюдалось уже большое разрушение (рис. 10). Обращает внимание лишь небольшое уменьшение активности фосфатазы в опыте при очень малой дозе апатогенного штамма BCG.
Все это характеризует первую фазу развития бугорка, длящуюся от 12 до 15 дней, причем переход в следующую, вторую, фазу зависит от итога ферментативных процессов в этот начальный период; при благоприятном комплексе ферментативных процессов происходит полное разрушение бактерий и восстановление нормальной жизни инфицированного участка.
Это имеет место или при весьма активных ферментах ткани, или при слабом угнетении дыхания токсинами, например, при малой патогенности микроба (особо вирулентные микробы, как показывают наши опыты, вызывают сильное угнетение дыхания).
При весьма высокой индивидуальной или видовой активности клеточных ферментов токсины быстро разрушаются, чем купируется и их патогенное, туберкулообразующее действие. Такое объяснение подтверждается и опытами сравнительного изучения влияния туберкулезных токсинов на дыхание различных органов. Оказалось, что токсин, сильно угнетающий дыхание клеток легких, меньше угнетает дыхание сильных в ферментативном отношении клеток печени (Η. Ε. Прокопенко, Г. Е. Платонов и 3. С. Васильева). При малоактивных клеточных ферментах микобактерии и их токсины не разрушаются и вызывают долго длящуюся воспалительную реакцию с последующим разрушением тканей.
Снижение окислительных процессов и фосфатазы в первой фазе реакции ведет к ослаблению разрушения туберкулезных микобактерии и их продуктов, в частности их липоидной фракции, накопление которой, вероятно, и вызывает переход лимфоидной фазы в эпителиоидную. Способность липидов туберкулезных микобактерии вызывать образование эпителиоидных клеток доказана рядом современных опытов.
Первая, лимфоидная, фаза в случае функционально-ферментативной недостаточности (т. е. при неспособности разрушать туберкулезные микобактерии и их липиды до конца) переходит в эпителиоидную с формированием некротических очагов с новыми условиями среды как для бактерий, так и для клеточных процессов.
Чаще всего первая фаза при большой вирулентности микобактерии, при сильном угнетении дыхания и связанном с ним большом гликолизе переходит во вторую фазу развития бугорка с уже значительными клеточными нарушениями в органе. Во второй фазе в лимфатических узлах особенно ясно выступает эпителиоидный характер клеточной реакции.
Вторая фаза характеризуется усилением тканевого дыхания, гликолиза и фосфатазы и начинается с момента полного развития бугорка и всасывания из него в окружающую ткань продуктов начального аутолиза клеток бугорка, погибших в первую фазу его развития.
Усиление окислительных процессов в туберкулезной ткани происходит как за счет стимулирования этих процессов продуктами распада и образующимися метаболитами, что доказано нашими опытами, так и за счет значительной пролиферации под их же влиянием сильно дышащих и сильно гликолизирующих соединительнотканных элементов, составляющих ткань бугорка.
Наступающее усиление окислительных процессов вначале удовлетворяется за счет усиленного подвоза кислорода кровью по расширенным сосудам. Но скоро усиление обмена приводит к увеличению проницаемости капиллярной стенки, что способствует проникновению белков плазмы в межклеточные пространства и как бы блокирует клетки воспалительного участка органа от проникновения кислорода, питательных веществ и препятствует выведению метаболитов, так как в белковой среде диффузионные процессы протекают слабее. Плохая васкуляризация бугорка также способствует кислородному голоданию.
Повышение в этот период темпа окислительных процессов при отставании притока кислорода вызывает в конце концов понижение окисления, сопровождающееся накоплением в бугорке недоокисленных промежуточных продуктов обмена. Возникшие условия благоприятствуют развитию аноксемического состояния и аноксибиотических процессов — усилению гликолиза и образованию молочной кислоты.
Накопление кислых продуктов, для нейтрализации которых путем окисления не хватает кислорода, увеличивается из-за нарушения нейтрализации их путем использования щелочных резервов плазмы вследствие трудности диффузии через богатый белками экссудат. Возникает, таким образом, местный ацидоз, который еще более осложняет развитие туберкулезного очага за счет связанных с ним процессов. Наши исследования показывают, что рН бугорка равен 4,5—5,0.
Обменные процессы в воспаленном очаге в известной степени делаются независимыми от всего организма, как бы осумковываются. Содержание сахара в очаге быстро уменьшается и через 60—90 часов достигает 6 — 15 мг%; содержание же молочной кислоты увеличивается до 125 мг%.
Уже давно отмечалось изолированное положение бугорка вследствие особенностей его строения — кольцевой зоны из лимфоидных элементов и почти полного отсутствия васкуляризации.
При изучении срезов, изготовленных из бугорков, изолированных от окружающей, не пораженной туберкулезом ткани, отмечена большая активность их клеточного дыхания, значительно превосходящая усиленное дыхание окружающей бугорок ткани. Причину такой активности клеточного дыхания можно объяснять как стимуляцией клеток бугорка ег о метаболитами, так и особенностью клеточных элементов, составляющих бугорок и по активности своих ферментов приближающихся к эмбриональным.
Не менее интенсивные и закономерные данные, облегчающие понимание патогенеза туберкулеза, получены и при исследовании гликолиза в процессе развития туберкулеза; они показали, что первой фазе пониженного клеточного дыхания здесь соответствует фаза усиленного гликолиза.