Реферат: Способы получения алюминия
Современные электролизеры оборудованы системой автоматического питания глиноземом (АПГ) с периодом загрузки 10–30 мин.
Суммарная реакция, происходящая в электролизере, может быть представлена уравнением
![]()
Таким образом, теоретически на процесс электролиза расходуются глинозем и углерод анода, а также электроэнергия, необходимая не только для осуществления электролитического процесса – разложения глинозема, но и для поддержания высокой рабочей температуры. Практически расходуется и некоторое количество фтористых солей, которые испаряются и впитываются в футеровку. Для получения 1 т алюминия необходимо:
| глинозема, кг | 1925 – 1930 |
| углерода анода, кг | 500 – 600 |
| фтористых солей, кг | 50 – 70 |
| электроэнергии (в переменном токе), кВт-ч | 14500 – 17500 |
Производство алюминия является одним из самых энергоемких процессов, поэтому алюминиевые заводы строят вблизи источников энергии.
Все материалы, поступающие на электролиз, должны иметь минимальное количество примесей более электроположительных, чем алюминий (железо, кремний, медь и др.), так как эти примеси при электролизе практически полностью переходят в металл.
3. Альтернативные способы получения алюминия
Промышленный способ получения алюминия электролизом криолитоглиноземных расплавов, несмотря на длительное его применение, имеет ряд существенных недостатков: высокий удельный расход электроэнергии, низкие удельный съем металла и срок службы электролизеров, большие трудовые и капитальные затраты, выделение вредных веществ в атмосферу и ряд других. В связи с этим предлагаются другие способы получения алюминия. Рассмотрим некоторые из них.
3.1. Электротермическое получение алюминиево-кремниевых сплавов.
Получить чистый алюминий непосредственным восстановлением его оксида невозможно [5]. Карботермические процессы требуют высоких температур (около 2000°С) для восстановления глинозема и при отсутствии сплавообразующих компонентов металл связывается с углеродом, давая карбид алюминия (А14 С3 ). Известно, что карбид алюминия и алюминий растворимы друг в друге и образуют весьма тугоплавкие смеси. Кроме того, А14 С3 растворяется в А12 О3 , поэтому врезультате восстановления оксида алюминия углеродом получаются смеси алюминия, карбида и оксида, имеющие высокие температуры плавления. Выпустить такую массу из печи обычно не представляется возможным. Даже если это и удается сделать, потребуются большие затраты на разделение.
В нашей стране впервые в мире разработан и осуществлен в промышленном масштабе с достаточно высокими технико-экономическими показателями способ получения силикоалюминия (алюминиево-кремниевых сплавов).
Общая технологическая схема производства алюминиево-кремниевых сплавов представлена на рис. 3.1. В качестве исходного сырья, кроме каолинов (Al2 O3 ×2SiO2 ×2H2 O), могут быть использованы кианиты (Al2 O3 ×SiO2 ), дистенсиллиманиты (Al2 O3 ×SiO2 ) и низкожелезистые бокситы.
Сплав после электроплавки поступает на очистку от неметаллических примесей. Для этого подают флюс, состоящий из смеси криолита и хлорида натрия, который смачивает эти примеси и "собирает" их. Рафинированный силикоалюминий имеет средний состав (%): А1 – 61; Si – 36; Fe – 1,7; Ti – 0,6; Zr – 0,5; Ca – 0,7. Этот сплав не годится для производства силумина и требует очистки от железа. Наиболее распространен способ очистки марганцем, который образует с железом тугоплавкие интерметаллиды.

Рис. 3.1. Общая схема производства алюминиево-кремниевых сплавов.
Полученный сплав разбавляют техническим электролитическим алюминием или вторичным алюминием до состава, отвечающего различным сортам силуминов, и разливают в слитки.
Преимущества такого способа получения силумина перед сплавлением электролитического алюминия с кристаллическим кремнием состоят в следующем: большая мощность единичного агрегата – современные печи имеют мощность 22,5 MB×A, что примерно в 30 раз выше мощности электролизера на 160 кА, а, следовательно, уменьшение грузопотоков, снижение капитальных затрат и затрат труда; применение сырья с низким кремниевым модулем, запасы которого в природе достаточно велики.
Теоретически из алюминиево-кремниевого сплава можно выделить различными приемами чистый алюминий. Однако из-за сложности аппаратурного и технологического оформления в промышленности эти способы в настоящее время не реализуются.
3.2. Субгалогенидный процесс
Известно, что если нагреть смесь галогенида и загрязненного алюминия, то при понижении температуры выделяется чистый алюминий. Это открытие вызвало интерес к системам алюминий – галогенид алюминия. Было определено, что металлический алюминий реагирует с А1Х3 (где X – галоген) при высокой температуре, образуя субгалогенид алюминия:
![]()
Поскольку субгалогенид алюминия является газообразным продуктом, равновесие смещается влево при понижении температуры. Например, А1С1(Г) можно получить из А1 и А1С13 в реакционной зоне при относительно высоких температурах, а затем перенести в парообразном состоянии в более холодную зону, где он диспропорционирует на чистый алюминий и хлорид алюминия. Константа равновесия для системы А1 – А1С13 выше, чем для системы А1 — A1F3 , и поэтому хлоридная система может быть использована для промышленных процессов. Температура образования субхлорида около 1300°С при атмосферном давлении. Этот процесс особенно привлекателен для выделения алюминия из сплавов, так как галогенид алюминия взаимодействует с алюминием и практически не взаимодействует с большинством других металлов. Трудности возникают только с некоторыми летучими галогенидамн, такими как FeCl3 , МпС12 , и некоторыми другими. Они могут образовывать смеси с А1С13 и загрязнять получаемый алюминий.
Фирмой "Alcan" разработана технология, включающая пять стадий:
1. Производство сырого сплава, например железо-кремниево-алюминиевого, в печи карботермическим восстановлением.
2. Взаимодействие между А1 и AJC1, в конвертере при температуре 1300 °С.
3. Разделение парообразных галогенидов и субгалогенида в ректификационных колоннах.
4. Возврат AICI, для реакции между хлоридом и жидким сплавом, богатым алюминием.
5. Разложение А1С1, получение алюминия и возврат А1С13 на ректификацию.
Субхлоридный метод представляет наибольший интерес для промышленного рафинирования алюминиевых сплавов.
3.3. Тот-процесс
Схема получения алюминия по способу Тота представлена на рис. 3.2. Алюминийсодержащее сырье после соответствующей подготовки хлорируют в кипящем слое в присутствии кокса и SiCl4 . Последний используется для подавления реакции хлорирования SiO2 . В результате хлорирования в печах кипящего слоя (КС) получается парогазовая смесь (ПГС), в состав которой входят А1С13 , FeCl3 , TiCl4 и SiCl4 . В первом конденсаторе из ПГС выделяется около 75 % FeCl3 в твердом состоянии и направляется в реактор-окислитель, где взаимодействует с кислородом воздуха, в результате чего образуются Fe2 O3 и С12 . Хлор возвращается на хлорирование. Во втором конденсаторе выделяется оставшийся FeCl3 и происходит конденсация А1С13 . Хлориды титана и кремния конденсируются в третьем конденсаторе. Разделение этих хлоридов осуществляется в ректификационной колонне.
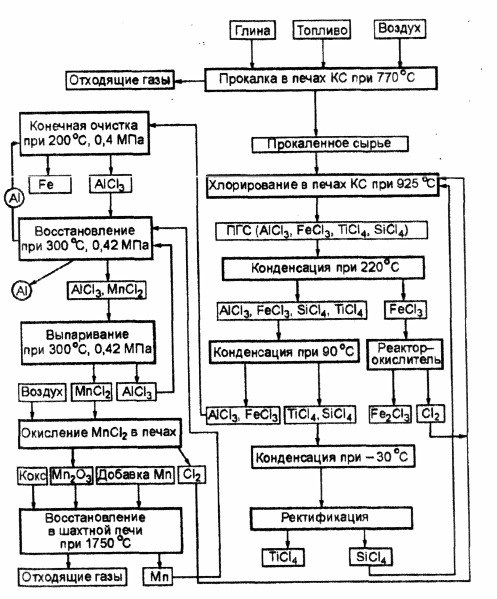
Рис. 3.2. Схема получения алюминия по методу Тота.