Реферат: Цепные разветвлённые реакции
 (9.1)
(9.1)
1) Цепной разветвлённый процесс есть результат суперпозиции стадий четырёх типов: зарождения, продолжения, разветвления и обрыва. На стадии продолжения число активных центров остаётся неизменным. Поэтому желательно в уравнении 3) от неё избавиться, и сосредоточиться на трёх основных стадиях, конкуренция которых формирует специфику именно разветвлённого процесса.
2) Поскольку за разветвление ответственны наиболее активные частицы - атомарный водород, то цель преобразований состоит в том, чтобы именно его концентрацию ввести всюду в явном виде. Равенство ![]() позволяет записать:
позволяет записать:  . Благодаря уравнению 2) из главного в нашей задаче уравнения 3) :
. Благодаря уравнению 2) из главного в нашей задаче уравнения 3) :
а) исключаем скорость ![]() , и б) заменяем скорость
, и б) заменяем скорость ![]() скоростью
скоростью ![]() , и получаем формулу (9.2).
, и получаем формулу (9.2).
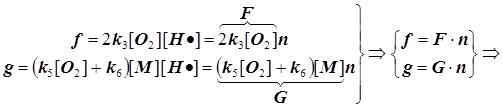
![]() (9.2)
(9.2)
Режимы разветвлённой цепной реакции
Конкуренция разветвления и обрыва
f -скорость разветвления цепи и F - фактор разветвления,
g -скорость обрыва цепи и G - фактор обрыва:
Режимы образования и гашения активных центров n:
![]()
![]()
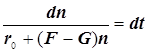
![]()
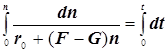
![]()
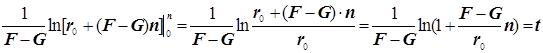
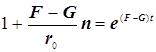
![]()
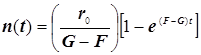 (9.3)
(9.3)
Полученное выражение предсказывает два предельных режима изменения концентрации активных центров, (см. рис.): а)-при доминирующем обрыве цепи система стационарно насыщается активными центрами; б)-при доминирующем разветвлении активные центры способны неограниченно накапливаться.
Эти предельные режимы цепной разветвлённой реакции (рис. ) следующие:

В результате конкуренции разветвления и обрыва возникает специфический механизм цепной разветвлённой реакции, зависящий от многих факторов. В книге Лейдлера (стр.194) рассматриваются взрывные пределы этой реакции. Цитируем: “Реакция водорода с кислородом протекает со скоростями, удобными для измерения между 450 и 600о С; выше этого интервала все смеси взрываются. Если стехиометрическую смесь (H2;O2) держать при (T; p)=(550 оС; 2 тор), то протекает гомогенная реакция. С постепенным повышением давления скорость реакции увеличивается. При некотором критическом давлении, величиною в несколько миллиметров (его точное значение зависит от размеров и формы реакционного сосуда), смесь взрывается. Если смесь выдерживать при p =200 тор, то вновь протекает спокойная стационарная реакция, но, если давление понизить, то при p =100 тор смесь взорвётся. Таким образом, при этой температуре имеется некоторый интервал давлений, внутри которого наблюдается взрыв, а выше и ниже его реакция протекает со стационарной скоростью. Выше 600 оС смесь взрывается при всех давлениях, а ниже 400 оС не взрывается совсем. Два взрывных предела называют первым и вторым или верхним и нижним.
Существует также и третий предел при ещё более высоких давлениях. Иногда этот третий предел является просто термическим пределом; и в этих случаях скорости реакций становятся настолько высокими, что условие изотермичности не сохраняется. Такие взрывы, которые происходят за счёт повышения температуры реакционной системы, называют термическими (тепловыми) . Существуют доводы и в пользу того, что взрыв при третьем пределе в системе (H2;O2) не является термическим, а происходит за счёт внезапного повышения концентрации активных центров-свободных радикалов...”.
Представим исходные состояния реакционной смеси в виде диаграммы в координатах температура – давление (T-p). Координатная плоскость оказывается разделённой на две области Z -образной кривой (-aebdc-) (рис.).
t
|
t
|
Слева от кривой (-aebdc-) лежит область, охватывающая состояния газовой смеси, при которых не развивается цепное разветвление, и реакция протекает в стационарном режиме.
Справа от кривой (-aebdc-) координатная плоскость отображает уже те состояния реакционной среды, при которых реакция протекает в режиме цепного разветвления, и развивается воспламенение. Рассмотрим изотермическую реакционную смесь (T=const) при переменном давлении. Фигуративная точка M перемещается вдоль вертикали, пересекая при этом три ветви кривой (-aebdc-).
Ветвь, на которой лежат точки dc, называется 1-м пределом цепного воспламенения.
Ниже этого предела давление в системе настолько мало, что активные частицы успевают совершить свободный пробег практически до стенки сосуда, не встречаясь в объёме с другими частицами. Это область, где доминирует линейный обрыв цепи (стадия 6).