Реферат: Влияние температуры на скорость химических реакций
5.2 Связь энергии активации с тепловым эффектом
Пусть протекает реакция:
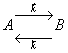
Тогда для прямой реакции
![]() и
и ![]() ;
;
для обратной реакции
![]() и
и ![]() ,
,
вычитая из первого уравнения второе, получим:
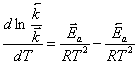 ,
,
но ![]() ,
,
где К – константа равновесия,
тогда
![]() .
.
![]() ,
,
где ΔН – тепловой эффект реакции.
Сравнив два последние уравнения, получим:
![]() . (5.8)
. (5.8)
Из уравнения 5.8 следует, что разность между энергиями активации прямой и обратной реакции равна тепловому эффекту.
Контрольные вопросы:
1. Правило Вант–Гоффа. Что такое температурный коэффициент реакции?
2. Изменение энергии активации в ходе экзотермической реакции.
3. Изменение энергии активации в ходе эндотермической реакции.
4. Дать определение энергии активации. Что такое активированный комплекс?
5. Уравнение Аррениуса. Как зависит константа химической реакции от температуры?
6. Вывести уравнения связи энергии активации с тепловым эффектом.