Реферат: Возбуждение, ионизация и отклоняющееся напряжение атома. Схемы энергоуровней
Отсюда следует, что
Ui или ![]() , (3а)
, (3а)
где l , см, - длина отклоняющих пластин; d , см, - расстояние между пластинами; z , см - расстояние от центра отклоняющих пластин до коллектора; Uб , в, - ускоряющее напряжение; UD 0 - U0 , в, - отклоняющее напряжение; Uб - Ui , в, - вольт-эквивалент энергии электронов после соударения с атомом газа, вызывающих его ионизацию или возбуждение.
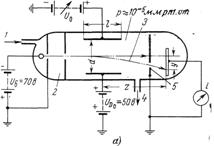
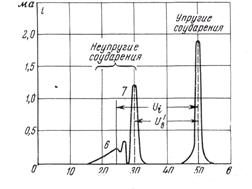
А) б)
Рис. 3. Экспериментальный прибор (а) и данные измерений (б) для определения потенциалов ионизации и возбуждения газов методом электронной спектроскопии.
Ui - потенциал ионизации гелия (≈25 в); U`в - минимальный потенциал возбуждения гелия (≈20 в);
1 - впуск газа; 2 - пространство соударений р = - 10-3 мм рт. ст.; 3 - электронный луч; 4 - к насосу; 5 - диафрагма со щелью; 6 - ионизация; 7 - возбуждение.
Отклоняющее напряжение
Для гелия (имеющего 2 электрона в первой двухэлектронной К -оболочке) потенциал ионизации равен Ui = 24,5 в ; для водорода (имеющего один электрон в K -оболочке, обладающий прочной связью с ядром, благодаря близкому расположению от ядра) Ui = 13,5 в ; для бария (имеющего два электрона в первой оболочке, 8 электронов во второй, по 18 электронов в третьей и четвертой и по 8 электронов в пятой и шестой оболочках) Ui = 5,2 в .
Эти данные относятся к однократному (простому) процессу ионизации, т. е. к процессу испускания одного, наиболее слабосвязанного (первого) электрона внешней оболочки. Этот же электрон при возбуждении атома первым переходит на более высокий энергетический уровень; при возвращении его (обратном переходе) на прежнюю орбиту происходит излучение света. Поэтому его называют иначе «оптическим» электроном.
3. Схема энергетических уровней
Схема возможных энергетических состояний атома газа. Возможные энергетические состояния электронной оболочки атома можно изобразить с помощью достаточно простой диаграммы; при этом по оси ординат откладывается энергия электрона, а сферические электронные оболочки изображаются прямыми линиями.
На рис. 4 показано образование схемы уровней с отдельными энергетическими состояниями электронов.
В качестве нулевого уровня целесообразно выбрать внешнюю электронную оболочку, т. е. энергетическое состояние оптического электрона невозбужденного атома («основное состояние»). Выше от него расположены возбужденные уровни, а ниже - рентгеновские энергетические уровни (рентгеновские термы). Заштрихованная область на рис.4 представляет собой область непрерывного спектра энергии. Если оптический электрон достигнет этой энергетической области, то он становится свободным и дальнейшая передача ему энергии приводит лишь к увеличению его кинетической энергии.
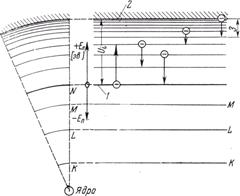
Рис. 4. Схема разрешенных энергетических уровней атома газа.
1 - основной уровень «оптического» электрона (валентная оболочка); 2 - уровень вакуума; 3 - энергия излучаемого кванта света.
В схеме термов атома (например, атома ртути на рис.5) основное и ионизированное состояния, так же как разрешенные (возможные) возбужденные состояния, обозначены горизонтальными линиями. Разность энергий на схеме переходов энергетической диаграммы выражена в электрон-вольтах (левая ось ординат) или в волновых числах ω = l/λ = v/ c , см-1 (правая ось ординат). Верхняя граница схемы соответствует потенциалу ионизации Ui . Косыми линиями изображены возможные переходы между различными уровнями; при этом жирными линиями обозначены наиболее часто встречающиеся переходы, тонкими - редко встречающиеся квантовые переходы. Числа относятся к длинам волн испускаемого излучения (например, 2536 Å) при данном переходе электрона.
Схема термов атома ртути на рис.5 разделена на две части: на синглетные и триплетные термы. Если первые возникают только как отдельные (единичные) термы (например, 2 S ), то вторые группируются по три рядом лежащих уровня (например, 2 p1 , 2 p2 , 2 p3 ). Такая мультиплетность имеет место у тех атомов, которые обладают более чем одним валентным электроном. В результате этого в таких атомах при подведении одной и той же величины энергии вероятность возбуждения нескольких валентных электронов больше, чем возбуждение одного оптического электрона. Дальнейшее расщепление термов на S- , Р- , D - и F- термы возникает в результате электростатического воздействия на оптический электрон со стороны атомнго остова.
Схема энергетических уровней атомного ядра. Не все схемы энергетических уровней строятся на основе боровской модели электронных оболочек. В ядерной физике используют также схемы энергетических уровней, как наглядный способ представления энергетического спектра радиоактивного распада определенного радиоактивного элемента. Такую схему энергетических уровней ядра можно построить, если принять, что нуклоны (протоны и нейтроны) расположены на определенных энергетических уровнях (рис. 6).
При α-, β - или γ-распаде «возбужденное» ядро переходит на более низкий энергетический уровень или на основной уровень ядра, который соответствует последнему элементу данного радиоактивного ряда. Например, при распаде RаС большая часть экспериментально найденных энергетических уровней вызваны γ-излучением, а некоторые из них обусловлены испусканием β - и α-частиц (рис.6).

Рис. 5. Схема уровней и линейчатый спектр атомов ртути.
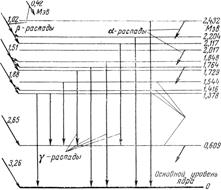
Рис.6. Схема уровней для распада RаС -RаС'.
Литература
1. Достанко А.П. Технология интегральных схем.-Мн: Вышэйшая школа, 2002 - - 206 с.
2. Гурский Л.И., Степанец В.Я. Проектирование микросхем.-Мн.: Навука i тэхнiка, 2001 - - 295 с.
3. Гурский Л.И., Зеленин В.А., Жебин А.П., Вахрин Г.Л. Структура, топология и свойства пленочных резисторов.-Мн.: Навука i тэхнiка, 2007 - - 250 с.