Реферат: Загальна характеристика хімічних властивостей Купруму
Cu + HNO3 = Cu(NO3 )2 + NO2 + H2 O
| Реакція | Коефіцієнт | Речовина |
| Cu – 2e = Cu2+ | 1 | Відновник |
| NO3 - + 2H+ + 1e = NO2 + H2 O | 2 | Окисник |
Cu + 4HNO3 = Cu(NO3 )2 + 2NO2 + 2H2 O
Виділення водню в реакціях із нітратною кислотою не відбувається.
· Сульфатною (VI) кислотою різних концентрацій
Із сульфатною кислотою ![]() мідь утворює Купруму (ІІ) сульфат та SО2 :
мідь утворює Купруму (ІІ) сульфат та SО2 :
Сu0 + 2Н2 S+6 O4(конц ) = Cu+2 SO4 + S+4 О2 + 2H2 O
Сu0 -2е = Сu+2 2 2 1 відновник окиснюється
S+6 +2е = S+4 2 1 окисник відновлюється
Реакція із сульфатною кислотою відбувається досить повільно у випадку розбавлених розчинів та значно швидше при використанні концентрованих розчинів та нагрівання. У багатьох літературних джерелах (1, ст. 555) вказується, що розбавлена сульфатна кислота не реагує із міддю, але реально провести межу при якій концентрації починає проходити реакція неможливо, адже на швидкість протікання реакції впливають температура, тиск, наявність домішок. Тому більш вірно буде вважати, що при низьких концентраціях кислоти реакція відбувається досить повільно.
· Сумішами кислот (![]() та іншими)
та іншими)
Із сумішами кислот мідь теж вступає у хімічну взаємодію. В таких реакціях утворюються, як правило, комплексні сполуки міді.
Якщо використати суміш хлоридної та нітратної кислот ![]() , то у випадку міді буде утворюватися
, то у випадку міді буде утворюватися ![]() . Якщо використати суміш фтороводневої та нітратної кислот
. Якщо використати суміш фтороводневої та нітратної кислот ![]() , то при дії суміші на мідь утворитися фторидний комплекс міді, де координаційне число складатиме 6:
, то при дії суміші на мідь утворитися фторидний комплекс міді, де координаційне число складатиме 6: ![]() .
.

Рис. 1. Структура фторидної комплексної сполуки Купруму.
На рисунку 1 наведена будова фторидного комплексу Купруму, як видно із рисунка, фторидний комплекс має октаєдричну будову.
· Розчином або розтопом лугу
Мідь не являється амфотерним елементом і не вступає у реакції взаємодії із лугами.
· Розчинами солей з урахуванням гідролізу останніх
Мідь витісняє із розчинів солей ті метал, які розташовані у ряді напруг перед нею. До таких металів відносяться цинк, алюміній, хорм та багато інших. Нижче наведена реакція купрум (ІІ) сульфату із цинком:
![]()
Слід враховувати, що у розчинах солі купруму гідролізуються, особливо солі утворені слабкими кислотами, наприклад ацетати, йодиди, броміди. Тому потрібно враховувати гідроліз при складанні рівнянь реакцій.
![]()

Тому під час реакції із цинком будуть утворюватися продукти:
![]()
2. На підставі відповідних термодинамічних розрахунків (визначення ![]() ,
, ![]() ,
, ![]() ) та аналізу значень окисно - відновних потенціалів встановіть імовірність перебігу реакцій, вказаних викладачем, та вкажіть умови їх реалізації (діапазон температур).
) та аналізу значень окисно - відновних потенціалів встановіть імовірність перебігу реакцій, вказаних викладачем, та вкажіть умови їх реалізації (діапазон температур).
Нехай нам вказані реакції:![]()
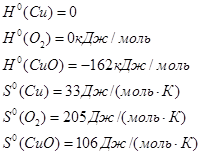
Тепловий ефект розраховують за стандартними теплотами утворення та згоряння. Тепловий ефект реакції рівний різниці між алгебраїчними сумами теплот утворення продуктів реакції та вихідних речовин:
![]() , тоді зміна ентальпії системи буде рівною:
, тоді зміна ентальпії системи буде рівною: ![]()