Статья: Горячие точки современной геронтологии
М.А.Булгаков. Мастер и Маргарита
В последние годы наиболее популярна свободноpадикальная теоpия стаpения. Практически одновременно выдвинутая Д.Харманом (1956) и Н.М.Эмануэлем (1958), она объясняет не только механизм старения, но и широкий круг связанных с ним патологических процессов (сердечно-сосудистых заболеваний, возрастной иммунодепрессии, дисфункции мозга, катаракты, рака и некоторых других). Согласно этой теоpии, пpодуциpуемые главным образом в митохондриях активные формы кислорода (О2-., Н2О2, НО·, О2) повpеждают клеточные макpомолекулы. Подсчитано, что за 70 лет жизни человека организм производит около тонны радикалов кислорода, хотя только 2-5% вдыхаемого с воздухом кислорода превращается в его токсические радикалы.
В клетке крысы за день может образоваться до 104 вызванных активными формами кислорода повреждений ДНК, и до 10% молекул белка могут иметь карбонильные модификации. Подавляющее большинство из них нейтрализуется еще до того, как успеют повредить те или иные компоненты клетки. Так, из каждого миллиона супероксидных радикалов от ферментной защиты ускользает не более четырех.
Сегодня показано, что видовая продолжительность жизни коррелирует с активностью фермента супероксиддисмутазы (СОД), содержанием -каротина, -токоферола и мочевой кислоты в сыворотке крови. Так, у долгоживущих линий D.melanogaster активность антиоксидантных ферментов (СОД, каталазы, глютатионредуктазы и ксантиндегидрогеназы) достоверно выше, чем у короткоживующих линий мух [14].
В пользу свободнорадикальной теории старения говорят и эксперименты, в которых трансгенные линии D.melanogaster с дополнительными копиями генов, обеспечивающих избыточную активность СОД и каталазы, жили на 20-37% дольше контрольных мух. Мухи с избыточными копиями генов одного из этих ферментов таким свойством не обладали [8]. Витамин Е, мелатонин, хелатные агенты и некоторые синтетические антиоксиданты увеличивали продолжительность жизни не только дрозофил, но и лабораторных мышей и крыс. Поскольку продукты взаимодействия активных форм кислорода с макромолекулами постоянно обнаруживаются в органах и тканях организма, это означает, что системы антиоксидантной защиты недостаточно эффективны и клетки постоянно испытывают окислительный стресс. Противодействие ему может играть существенную роль в механизме геропротекторного действия эндогенных и экзогенных антиоксидантов.
Меньше калорий - длиннее жизнь
|
Диета, которая обильна, опасна, и также опасно избыточное насыщение. Те, кто от природы жирны, ближе к смерти, чем те, которые тощи. Гиппократ. 477-460 гг. до н.э. |
Еще в 30-е годы ХХ в. установили, что диета с существенным (на 40%) ограничением калорий увеличивает на 30-50% максимальную и среднюю продолжительность жизни крыс и мышей. Ограничение пищи увеличивало продолжительность жизни также у рыб, амфибий, дафний, насекомых и других беспозвоночных. В трех больших исследованиях на приматах (главным образом на макаках резус) показано, что некоторые физиологические эффекты низкокалорийной диеты, наблюдаемые у грызунов, воспроизводятся и у обезьян [4]. У них уменьшается уровень глюкозы и инсулина в крови, снижаются температура тела и энергозатраты. Установлено, что геропротекторный эффект голодания определяет общее снижение потребления калорий, а не какого-либо ингредиента пищи.
Подсчитано, что у грызунов при низкокалорийном рационе 80-90% из различных изученных параметров (поведение и обучаемость, иммунный ответ, экспрессия генов, активность ферментов и действие гормонов, толерантность к глюкозе, эффективность репарации ДНК, скорость синтеза белка) проявляло признаки замедленного старения. Такая диета стимулировала апоптоз, который выбраковывает пренеопластические клетки в тканях организма, замедляет накопление мутаций и развитие возрастной патологии.
Пожалуй, основное действие низкокалорийной диеты состоит в ослаблении интенсивности свободнорадикальных процессов. У грызунов при таком содержании замедляется скорость генерации супероксида и Н2О2, уменьшаются окислительные повреждения и падение вязкости мембран; голодание снижает чувствительность тканей in vitro к острому окислительному стрессу. Наибольший защитный в отношении окислительного стресса эффект низкокалорийного питания проявляется в постмитотических клетках головного мозга, сердца и скелетных мышц.
Группа специалистов из США и Италии [15] оценивала эффективность ограниченного питания у людей, соблюдавших низкокалорийную диету в течение шести лет, в сравнении со здоровыми людьми, придерживавшимися обычной американской диеты. 18 испытуемых (возраст от 35 до 82 лет) не курили, не имели хронических заболеваний, не принимали гиполипидемических, антигипертензивных или других лекарств и ежедневно потребляли от 1112 до 1958 кКал. В их рацион входили фрукты, овощи, орехи, злаки, белки и мясо (сладкие напитки, закуски и десерт исключались). 26% калорий они получали из белков, 28% из жиров и 46% из углеводов. Лица контрольной группы (18 человек) потребляли 1976-3537 кКал в день без ограничений в сладком. У испытуемых были меньшая масса тела, уровень общего холестерина, липопротеинов низкой плотности, триглицеридов, глюкозы, инсулина, С-реактивного белка, тромбоцитарного фактора роста АВ (PDGF-AB), систолического и диастолического артериального давления и выше уровень липопротеинов высокой плотности, чем в контрольной группе. Авторы полагают, что низкокалорийная диета существенно снизила риск развития атеросклероза, что подтверждалось уменьшением на 40% толщины интимы медиа артерий. У испытуемых отмечена также меньшая частота воспалительных процессов по сравнению с контрольной группой.
Однако обычный человек вряд ли сумеет на протяжении многих лет строго соблюдать подобную диету. Наиболее известный случай такого эксперимента на себе (при этом не вполне успешного) - опыт известного американского геронтолога и иммунолога Роя Уолфорда. В самые последние годы весьма “горячей точкой” стал поиск миметиков (имитаторов) ограниченной диеты. Предложенный американскими специалистами заменитель сахара 2-дезоксиглюкоза увеличивал продолжительность жизни грызунов, но обладал такими побочными эффектами, что от его использования в качестве геропротектора пришлось отказаться.
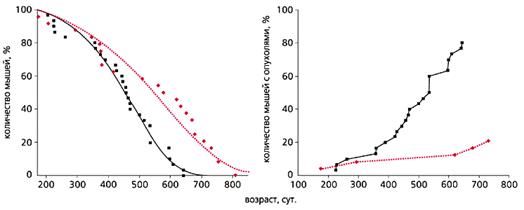
Рис. 2. Влияние фенформина (цветная кривая) на продолжительность жизни
и развитие спонтанных опухолей (справа) у самок мышей С3H/Sn [3].
Еще в 80-годы прошлого века с помощью некоторых фармакологических средств, в частности антидиабетических бигуанидов (повышают чувствительность тканей к инсулину, улучшают толерантность к углеводам, снижают уровень липидов и устраняют явления метаболической иммунодепрессии), также удается продлить жизнь мышей и крыс и снизить у них частоту спонтанных и индуцированных химическими канцерогенами или ионизирующей радиацией новообразований (рис.2). В нашей лаборатории антидиабетический бигуанид метформин увеличивал продолжительность жизни и тормозил развитие рака молочной железы у трансгенных мышей HER-2/neu (рис.3). А в клинике применение метформина снижает риск развития злокачественных новообразований у пациентов, страдающих сахарным диабетом типа 2.
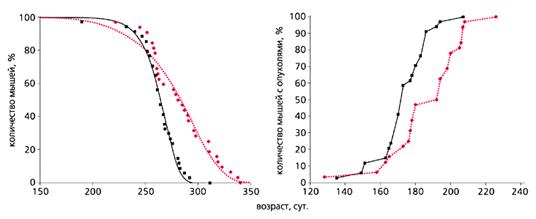
Рис. 3. Влияние метформина (цветная кривая) на продолжительность жизни
и развитие спонтанных опухолей (справа) у самок трансгенных мышей HER-2/neu [18].
Стареющие клетки: хорошие граждане, но плохие соседи
|
Не обольщайся призраком покоя: Бывает жизнь обманчива на вид. Настанет час, и утро роковое Твои мечты, сверкая, ослепит. Николай Заболоцкий |
В 1971 г. научный cотрудник Института биохимической физики РАН А.М.Оловников, используя данные о принципах синтеза ДНК в клетках, предложил гипотезу маргинотомии, объясняющую механизм работы счетчика клеточных делений. Согласно его гипотезе, ДНК-полимераза при матричном синтезе полинуклеотидов полностью не воспроизводит линейную матрицу, и реплика всегда получается короче в ее начальной части. Таким образом, при каждом делении клетки ее ДНК укорачивается, что ограничивает пролиферативный потенциал клеток и, очевидно, служит “счетчиком” числа делений и, соответственно, продолжительности жизни клетки в культуре. Открытие в 1985 г. фермента теломеразы, достраивающего укороченную теломеру в половых клетках и клетках опухолей, обеспечивая их бессмертие, стало блестящим подтверждением гипотезы Оловникова.
В последние годы достигнут значительный прогресс в изучении роли теломер в старении. Дисфункция теломер (связана ли с укорочением, прямым повреждением или ассоциированным с теломерой дефектным белком) может приводить к трем последствиям: старению клетки, ее гибели (факторы, подавляющие неопластический процесс) или нестабильности генома, которое может способствовать злокачественной трансформации клетки.
Старение клетки рассматривают как один из ее защитных механизмов при дисфункции теломер, поскольку оно останавливает пролиферацию, тем самым блокируя канцерогенез (“хорошие граждане”) [16]. В течение жизни в организме накапливаются соматические мутации, некоторые из них могут инактивировать гены, участвующие в клеточном старении. Кроме того, потеря гетерозиготности и мутации в генах-супрессорах (р53 и Rb) и онкогенах (например, ras) встречаются даже в нормальных клетках. Другой защитный механизм клетки с дисфункцией теломер, в который вовлечен интактный р53, - апоптоз. В клетках, где накапливаются мутации в гене р53 или в компонентах его регуляции, развивается нестабильность генома, повышающая вероятность злокачественной трансформации. Потеря дистальных областей теломер связана с уменьшением пролиферативной жизни клеток как in vitro, так и in vivo. Анализ данных по укорочению теломер в 15 различных тканях человека показал, что в год теломеры теряют от 20 до 60 пар оснований.