Статья: Строение веществ. Систематика химических элементов
где m – масса веществ, а Э – молярная масса эквивалентов.
Другими словами можно сказать, что вещества реагируют и образуются в эквивалентных количествах. Один эквивалент одного вещества всегда взаимодействует с одним эквивалентом другого.
Эквивалент – реальная или условная частица, которая может присоединять, высвобождать или быть каким–либо другим образом эквивалентна одному иону водорода в кислотно–основных реакциях или одному электрону в окислительно–восстановительных реакциях.
При использовании понятия «эквивалент» всегда необходимо указывать, к какой ионной реакции оно относится.
![]()

![]()

![]()
![]()
Законы газового состояния
Закон объемных отношений (Гей–Люссака): при неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях (Т, р) содержится равное количество молекул.
Следствия из закона Авогадро:
При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
При н.у. 1 моль различных газов занимает объем 22,4 л (молярный объем газа, л/моль).
Отношение масс равных объемов различных газов равно отношению их молекулярных масс:
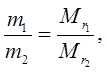
где m1 и m2 – массы, а ![]() и
и ![]() – молекулярные массы первого и второго газов.
– молекулярные массы первого и второго газов.
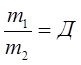 - относительная плотность первого газа по второму.
- относительная плотность первого газа по второму.
Тогда 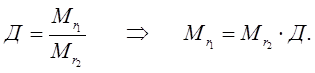
Объединенный газовый закон:
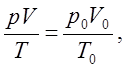
р0 = 101325 Па, Т0 = 0 ºС (273,15 К),
где р0, V0, Т0 – соответственно давление, объем, температура при н.у.; р, V, Т – те же параметры данного количества газообразного вещества при других условиях.
Для 1 моль любого газа при н.у.: 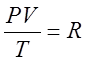 - универсальная газовая постоянная.
- универсальная газовая постоянная.
R = 8,314 Дж/(моль×К)
Для 1 моля газа тогда имеем:
![]()
Это уравнение состояния идеального газа.