Статья: Структурная организация белков
Выяснение структурной организации белков считается одной из главных проблем современной биохимии. Оно имеет важное научно-практическое значение для понимания огромного разнообразия функций белков, выполняемых ими в живых организмах. Белковые молекулы представляют собой продукт полимеризации 20 различных мономерных молекул (аминокислот), соединенных не хаотично, а в строгом соответствии с кодом белкового синтеза (см. главу 14). Вопрос о том, каким образом соединяются между собой многие десятки и сотни аминокислот в белковой молекуле, был предметом пристального внимания многих лабораторий мира, занимавшихся химией белка.
Впервые А . Я . Данилевский (1888), изучая биуретовую реакцию, высказал предположение о существовании во всех белковых веществах одинаковых групп атомов и связей, аналогичных биурету NH2—СО—NH—СО—NH2. Тем самым А.Я. Данилевский первый указал на связь —NH—СО— (позднее получившую название пептидной связи) как на наиболее вероятный способ соединения аминокислот в белковой молекуле.
Однако только Э. Фишер (1902) сформулировал полипептидную теорию строения. Согласно этой теории, белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии α-карбоксильных СООН- и α-NН2-групп аминокислот. На примере взаимодействия аланина и глицина образование пептидной связи и дипептида (с выделением молекулы воды) можно представить следующим уравнением:

Аналогичным способом к дипептиду могут присоединяться и другие аминокислоты с образованием три-, тетра-, пентапептида и т.д. вплоть до крупной молекулы полипептида (белка). Наименование пептидов складывается из названия первой N-концевой аминокислоты со свободной NH2-группой (с окончанием -ил, типичным для ацилов), названий последующих аминокислот (также с окончаниями -ил) и полного названия С-концевой аминокислоты со свободной СООН-группой. Например, пентапептид из 5 аминокислот может быть обозначен полным наименованием: глицил-аланил-серил-цистеинил-аланин, или сокращенно Гли–Ала–Сер–Цис–Ала.
Образование пептидных связей, например, из трех разных аминокислот может быть представлено в виде следующей схемы:
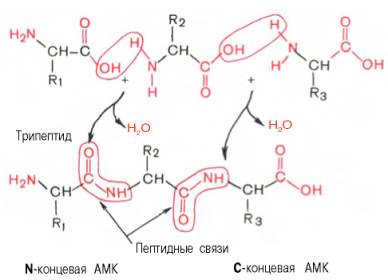
Химический синтез полипептидов и современные физико-химические методы исследования белков полностью подтвердили существование пептидных связей в структуре белка. Получены следующие экспериментальные доказательства полипептидной теории строения белка.
1. В природных белках сравнительно мало титруемых свободных СООН- и NH2-групп, поскольку абсолютное их большинство находится в связанном состоянии, участвуя в образовании пептидных связей; титрованию доступны в основном свободные СООН- и NН2-группы у N- и С-концевых аминокислот пептида.
2. В процессе кислотного или щелочного гидролиза белка образуются стехиометрические количества титруемых СООН- и NH2-групп, что свидетельствует о распаде определенного числа пептидных связей.
3. Под действием протеолитических ферментов (протеиназ) белки расщепляются на строго определенные фрагменты, называемые пептидами, с концевыми аминокислотами, соответствующими избирательности действия протеиназ. Структура некоторых таких фрагментов неполного гидролиза доказана последующим химическим их синтезом.
4. Биуретовую реакцию (сине-фиолетовое окрашивание в присутствии раствора сульфата меди в щелочной среде) дают как биурет, содержащий пептидную связь, так и белки, что также является доказательством наличия в белках аналогичных связей.
5. Анализ рентгенограмм кристаллов белков подтверждает полипептидную структуру белков. Таким образом, рентгеноструктурный анализ при разрешении 0,15–0,2 нм позволяет не только вычислить межатомные расстояния и размеры валентных углов между атомами С, Н, О и N, но и «увидеть» картину общего расположения аминокислотных остатков в полипептидной цепи и пространственную ее ориентацию (конформацию).
6. Существенным подтверждением полипептидной теории строения белка является возможность синтеза чисто химическими методами полипептидов и белков с уже известным строением: инсулина – 51 аминокислотный остаток, лизоцима – 129 аминокислотных остатков, рибонуклеазы – 124 аминокислотных остатка . Синтезированные белки обладали аналогичными природным белкам физико-химическими свойствами и биологической активностью.
Полипептидная теория строения не отрицает существования в молекуле белка и других связей, включая ковалентные (например, дисульфидные —S—S-связи) и нековалентные (например, водородные связи и др.). Они будут рассмотрены далее.
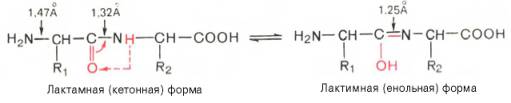
Пептидные связи играют исключительную роль как в «архитектуре», так и в функции белков. Поэтому следует указать на некоторые особенности строения полипептидной цепи. Во-первых, это своеобразие расположения атомов углерода и азота, находящихся примерно в одной плоскости, и атомов водорода и радикалов, направленных к этой плоскости под углом 109°28'. Во-вторых, это своеобразие петидной связи. Расстояние между атомами С и N в пептидной связи (равное 0,132 нм) является промежуточным между простой (ординарной) связью (связь —С—N—, равная 0,147 нм) и двойной связью (связь —C=N—, равная 0,125 нм). Это создает предпосылки для осуществления по месту двойной связи таутомерных перегруппировок и для образования енольной (лактимной) формы. Последняя в свою очередь дает молекуле белка ряд преимуществ (повышение реакционной способности, возникновение дополнительных возможностей вращения и др.):
Наконец, следует указать на своеобразие радикалов, которые являются полифункциональными, несущими свободные NH2-, СООН-, ОН-, SH-группы и, как было указано, определяют структуру (пространственную) и многообразие функций молекул белка. Взаимодействуя с окружающими молекулами растворителя (Н2О), функциональные группы (в частности, NH2- и СООН-группы) ионизируются, что приводит к образованию анионных и катионных центров белковой молекулы. В зависимости от соотношения ионов молекулы белка получают суммарный положительный (+) или отрицательный (–) заряд с определенным значением изоэлектрической точки.
Получены доказательства предположения К. Линдерстрёма-Ланга о существовании 4 уровней структурной организации белковой молекулы: первичной, вторичной, третичной и четвертичной структуры. Техника современной белковой химии разработана настолько хорошо, что позволяет в принципе расшифровать структурную организацию любого белка.