Учебное пособие: Типы химических связей
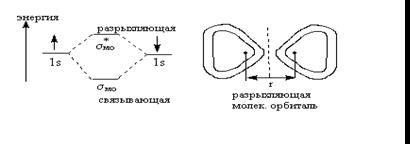
Энергетическая диаграмма для разрыхляющей и связывающей орбиталей
3. Структуры Льюиса
Связь между атомами обеспечивается электронными парами (американский химик Джилберт Льюис)
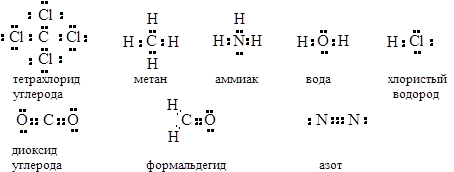
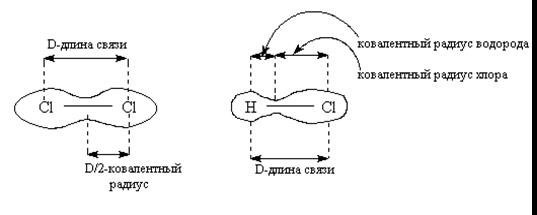
4. Некоторые свойства ковалентных связей (длина связи, полярность связи и энергия связи)
4.1 Длина связи
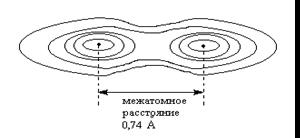
Минимальное расстояние между атомами отвечает минимальной потенциальной энергии системы.
Кривая потенциальной энергии (энергетический профиль)

2 - участок притяжения, вызванного индуцированной поляризацией (дисперсионые силы Лондона).
Половина расстояния, разделяющего атомы в точке 3, соответствует вандерваальсову радиусу.
Вандерваальсовы радиусы
|
Атом или группа |
Вандерваальсов радиус, Е |
|
Br |
1,35 |
|
CH2 |
2,0 |
|
CH3 |
2,0 |
|
Cl |
1,8 |
|
F |
1,35 |
|
К-во Просмотров: 384
Бесплатно скачать Учебное пособие: Типы химических связей
|