Дипломная работа: Экспериментальные исследования процесса тепломассообмена и химических реакций углерода с газами
где d – диаметр углеродной частицы, м; ![]() - предэкспоненциальный множитель, 1/с;
- предэкспоненциальный множитель, 1/с; ![]() - энергия активации реакции (ІV), Дж/моль;
- энергия активации реакции (ІV), Дж/моль; ![]() - температура газовой смеси, К;
- температура газовой смеси, К; ![]() - коэффициент диффузии окиси углерода, м2 /с; Nu – критерий Нуссельта. Малое значение критерия Семенова определяется экспериментальными условиями, когда частица дополнительно разогревается током высокой частоты или в результате поглощения лазерного излучения и обдувается холодным газом [5-7]. Так в [5] частица электродного угля d=1.2 – 1.5 см, нагреваемая током высокой частоты, обдувалась воздухом комнатной температуры (Тg =293 К) со скоростью V=0.6 м/с. В [6-7] приведены экспериментальные и теоретические результаты временных зависимостей температуры и диаметра углеродной частицы, горение которой в воздухе комнатной температуры поддерживается лазерным излучением.
- коэффициент диффузии окиси углерода, м2 /с; Nu – критерий Нуссельта. Малое значение критерия Семенова определяется экспериментальными условиями, когда частица дополнительно разогревается током высокой частоты или в результате поглощения лазерного излучения и обдувается холодным газом [5-7]. Так в [5] частица электродного угля d=1.2 – 1.5 см, нагреваемая током высокой частоты, обдувалась воздухом комнатной температуры (Тg =293 К) со скоростью V=0.6 м/с. В [6-7] приведены экспериментальные и теоретические результаты временных зависимостей температуры и диаметра углеродной частицы, горение которой в воздухе комнатной температуры поддерживается лазерным излучением.
Проведенный анализ тепломассообмена и кинетики химических реакций (І), (ІІ), (ІІІ) углеродной частицы с газами показал на необходимость учета стефановского течения и позволил получить аналитические выражения качественно верно описывающие влияние условий и свойств на газовый состав продуктов реакции, скорость химического превращения углерода, плотности тепловых и массовых потоков на поверхности частицы [3]. Однако, пренебрежение внутренним реагированием привело к несовпадению экспериментальных и расчетных результатов по скорости химического превращения углеродной частицы при различных ее температурах и диаметрах.
Задачей настоящей работы является выявление роли внутреннего реагирования и стефановского течения в процессах ТМО и химических реакций пористой углеродной частицы с газами с учетом вынужденной и естественной конвекции в зависимости от температуры и диаметра частицы.
Скорость химического превращения углерода в газообразные компоненты определяется скоростью химической реакции на внешней поверхности частицы и внутри частицы на поверхностях пор
![]() ,
,
где ![]() - соответственно, суммарная скорость химического превращения, скорость химического превращения на поверхности углеродной частицы и внутри, на поверхностях пор, кг/(м2 с).
- соответственно, суммарная скорость химического превращения, скорость химического превращения на поверхности углеродной частицы и внутри, на поверхностях пор, кг/(м2 с).
Скорость химического превращения углерода на поверхности частицы определяется кинетикой реакций (I), (II) и (III)
 , (2.1)
, (2.1)
![]()
![]() ,
,
![]() ,
,
где ![]() – молярные массы углерода, кислорода, углекислого газа, кг/моль;
– молярные массы углерода, кислорода, углекислого газа, кг/моль; ![]() – относительные массовые концентрации O2 и CO2 на поверхности частицы;
– относительные массовые концентрации O2 и CO2 на поверхности частицы; ![]() ,
, ![]() ,
, ![]() – константы скоростей химических реакций (I), (II), (III), м/с;
– константы скоростей химических реакций (I), (II), (III), м/с; ![]() ,
, ![]() ,
, ![]() - предэкспоненциальные множители, м/с; E1 , E2 , Е3 – энергии активации (I), (II) и (III) реакций, Дж/моль; R – универсальная газовая постоянная, Дж/(моль×К); Т – температура частицы, К;
- предэкспоненциальные множители, м/с; E1 , E2 , Е3 – энергии активации (I), (II) и (III) реакций, Дж/моль; R – универсальная газовая постоянная, Дж/(моль×К); Т – температура частицы, К; ![]() ,
, ![]() - плотность газа при температуре частицы и при Т0 =273.15 К, кг/м3 .
- плотность газа при температуре частицы и при Т0 =273.15 К, кг/м3 .
Энергии активации и предэкспоненциальные множители реакций (I), (II) и (III) связаны между собой [1]:
![]() ;
; ![]() ,
,
где ![]() =1 для реакции (I), 2- для реакции (II) и 3- для реакции (III).
=1 для реакции (I), 2- для реакции (II) и 3- для реакции (III).
Выражение для скорости химического превращения углерода в результате химических реакций на поверхностях пор внутри объёма частицы получается из решения задачи внутренней диффузии и может быть представлено в виде
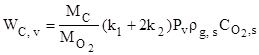 ,
, ![]() , (2)
, (2)
![]() , (3)
, (3)
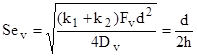 ,
, 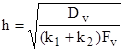 , (4)
, (4)
где ![]() -эффективная константа внутреннего реагирования, м/с; Sev - критерий Семенова, определяющий соотношение констант скоростей химических превращений на поверхностях пор и диффузии [8, 9] или отношение радиуса частицы к глубине реакционной зоны, Dv – коэффициент внутренней диффузии кислорода в порах, м2 /с;
-эффективная константа внутреннего реагирования, м/с; Sev - критерий Семенова, определяющий соотношение констант скоростей химических превращений на поверхностях пор и диффузии [8, 9] или отношение радиуса частицы к глубине реакционной зоны, Dv – коэффициент внутренней диффузии кислорода в порах, м2 /с; ![]() - глубина реакционной зоны внутреннего реагирования, м,
- глубина реакционной зоны внутреннего реагирования, м, ![]() – удельная поверхность пор, м-1 .
– удельная поверхность пор, м-1 .
Коэффициент внутренней диффузии выражается через порозность частицы [1, 5]
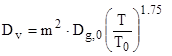 , (5)
, (5)
где ![]() - коэффициент диффузии кислорода в воздухе при температуре
- коэффициент диффузии кислорода в воздухе при температуре ![]() , м2 /с;
, м2 /с; ![]() - порозность частицы.
- порозность частицы.
Суммарная скорость химического превращения углеродной частицы и плотность химического тепловыделения
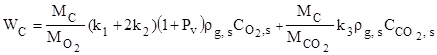 , (6)
, (6)
![]()
![]() , (7)
, (7)
где Q1 , Q2 – тепловые эффекты химических реакций (I) и (II), рассчитанные на единицу массы кислорода, Дж/кг; Q3 – тепловой эффект реакции (III), рассчитанный на единицу массы углекислого газа, Дж/кг; ![]() - суммарная плотность химического тепловыделения, на поверхности и внутри частицы, соответственно, Вт/м2 .
- суммарная плотность химического тепловыделения, на поверхности и внутри частицы, соответственно, Вт/м2 .
2.2. Взаимовлияние кинетики химических реакций и массообмена пористых углеродных частиц с газами.
Влияние относительной скорости движения частицы на кинетику химических реакций и тепломассообмен учитывается радиусом приведенной пленки ![]() , на поверхности которой задаются параметры невозмущенного потока [1, 2]. Для случая отсутствия вынужденной и естественной конвекций (частица неподвижна относительно газа, Nu=2) радиус приведенной пленки
, на поверхности которой задаются параметры невозмущенного потока [1, 2]. Для случая отсутствия вынужденной и естественной конвекций (частица неподвижна относительно газа, Nu=2) радиус приведенной пленки ![]() равен бесконечности. Радиус приведенной пленки уменьшается с увеличением интенсивности естественной и вынужденной конвекций, приближаясь к радиусу частицы
равен бесконечности. Радиус приведенной пленки уменьшается с увеличением интенсивности естественной и вынужденной конвекций, приближаясь к радиусу частицы ![]() . Зависимость
. Зависимость ![]() от критерия Нуссельта имеет вид:
от критерия Нуссельта имеет вид:
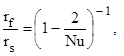 (8)
(8)
![]() , (9)
, (9)
![]() , [5, 10]
, [5, 10]
![]() ,
, 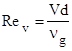 ,
, ![]() ,
, ![]() ,
,
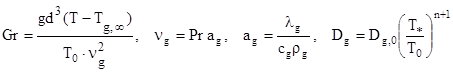 ,
,
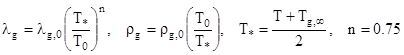 ,
,
где ![]()
![]() – критерии Рейнольдса, определяющие суммарную, вынужденную и естественную конвекции; Gr, Pr – критерии Грасгофа и Прандтля; V - относительная скорость частицы, м/с;
– критерии Рейнольдса, определяющие суммарную, вынужденную и естественную конвекции; Gr, Pr – критерии Грасгофа и Прандтля; V - относительная скорость частицы, м/с; ![]() g – кинематическая вязкость газа, м2 /с; g – ускорение свободного падения, м/с2 ; аg – температуропроводность газовой смеси, м2 /с;
g – кинематическая вязкость газа, м2 /с; g – ускорение свободного падения, м/с2 ; аg – температуропроводность газовой смеси, м2 /с; ![]() - коэффициент теплопроводности газовой смеси, Вт/(м К);
- коэффициент теплопроводности газовой смеси, Вт/(м К); ![]() - коэффициент теплопроводности газовой смеси при
- коэффициент теплопроводности газовой смеси при ![]() , Вт/(м К);
, Вт/(м К); ![]() - коэффициент массообмена, м/с;
- коэффициент массообмена, м/с; ![]() - удельная теплоемкость газовой смеси, Дж/(кг К);
- удельная теплоемкость газовой смеси, Дж/(кг К); ![]() - температура газовой смеси на бесконечном удалении от поверхности частицы, К;
- температура газовой смеси на бесконечном удалении от поверхности частицы, К; ![]() - коэффициент диффузии кислорода в газовой смеси, м2 /с;
- коэффициент диффузии кислорода в газовой смеси, м2 /с; ![]() - коэффициент теплообмена, Вт/м2 К.
- коэффициент теплообмена, Вт/м2 К.
Зависимости относительных массовых концентраций кислорода (![]() ), диоксида углерода (
), диоксида углерода (![]() ), оксида углерода (
), оксида углерода (![]() ) и азота (
) и азота (![]() ), а так же скорость стефановского течения (
), а так же скорость стефановского течения (![]() ), для
), для ![]() , находятся из решений уравнений, в которых левые части представляют потоки масс газообразных компонент через произвольную поверхность радиуса r, а правые – скорости образования или исчезновения масс этих компонент в результате химических реакций
, находятся из решений уравнений, в которых левые части представляют потоки масс газообразных компонент через произвольную поверхность радиуса r, а правые – скорости образования или исчезновения масс этих компонент в результате химических реакций
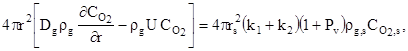

(10)
 ,
,
 ,
,
где ![]() – молярная масса угарного газа, кг/моль;
– молярная масса угарного газа, кг/моль; ![]() - текущая скорость стефановского течения, м/с.
- текущая скорость стефановского течения, м/с.
Предполагая, что коэффициенты диффузии компонент газовой смеси равны ![]() и, применяя условие,
и, применяя условие, ![]() , из (10) получим уравнение неразрывности
, из (10) получим уравнение неразрывности
![]() , (11)
, (11)
где Wc определяется формулой (6), ![]() - скорость стефановского течения на поверхности частицы, м/с.
- скорость стефановского течения на поверхности частицы, м/с.
Для решения (10) зададим граничные условия
![]()
и введем безразмерные координаты
 ,
,  . (12)
. (12)
Учитывая (8) и (9), получим, что безразмерная скорость стефановского течения на поверхности частицы
 ,
,
где ![]() - относительные массовые концентрации; j-1 для О2 , 2 - СО2 , 3 - СО, 4 - N2 ;
- относительные массовые концентрации; j-1 для О2 , 2 - СО2 , 3 - СО, 4 - N2 ; ![]() ― относительные массовые концентрации компонент газовой смеси на поверхности частицы и приведенной пленки.
― относительные массовые концентрации компонент газовой смеси на поверхности частицы и приведенной пленки.
Решение (10) и (11) представим в виде

![]() или
или ![]() (13)
(13)
Скорость химического превращения углерода в газообразные компоненты может оказывать влияние на интенсивность теплообмена поверхности частицы с газом. Для определения плотности теплового потока, характеризующего теплообмен частицы с газом, воспользуемся предположением о квазистационарности поля температуры газовой фазы и частицы. В этом случае (![]() ) тепловой поток через произвольную поверхность радиуса
) тепловой поток через произвольную поверхность радиуса ![]() является постоянным и равен произведению плотности теплового потока на поверхность частицы.
является постоянным и равен произведению плотности теплового потока на поверхность частицы.
 .
.
С учетом уравнения неразрывности (11) представим в виде
 .
.
Задавая граничные условия ![]() ,
, ![]() и безразмерные координаты в виде (12), решение представим в аналогичном (13) виде
и безразмерные координаты в виде (12), решение представим в аналогичном (13) виде
 ,
, ![]() .
.
При ![]() выражение для
выражение для ![]() получим в виде
получим в виде
![]() .
.