Дипломная работа: Исследование методов наблюдения доменов в тонких ферромагнитных пленках
Что касается отношения магнитного момента спина, равного магнетону Бора, m![]() , к его механическому моменту, равному (1/2) (h/2p), то оно составляет
, к его механическому моменту, равному (1/2) (h/2p), то оно составляет
(m/Р)![]() = 4pm
= 4pm![]() /h (14)
/h (14)
т.е. оказывается вдвое большим, нежели для электронной орбиты.
В указанном опыте Эйнштейна и Де-Гааза при перемагничивании можно измерить изменение как механического момента количества движения, так и магнитного момента, и взять их отношение. Многократно проведенные тщательные исследования показывают, что это отношение равно 4pm![]() /h. Таким образом, из эксперимента следует, что ферромагнетизм обусловлен не орбитальными а спиновыми магнитными моментами, именно они при определенных условиях устанавливаются в веществе так что возникает ферромагнетизм. Об этих условиях будет сказано ниже.
/h. Таким образом, из эксперимента следует, что ферромагнетизм обусловлен не орбитальными а спиновыми магнитными моментами, именно они при определенных условиях устанавливаются в веществе так что возникает ферромагнетизм. Об этих условиях будет сказано ниже.
1.6 Природа ферромагнетизма
Из предыдущего параграфа следует, что элементарными носителями ферромагнетизма являются электронные спины. Однако возникает вполне законный вопрос почему же электронные спины создают ферромагнетизм не во всех веществах, а только в некоторых, причем очень немногих? Почему ферромагнитны железо, никель, почему не ферромагнитны медь и серебро? Ведь и в атомах меди электроны вращаются вокруг ядра, обладая орбитальными магнитными моментами, и в атомах меди электроны вращаются вокруг своей оси и, таким образом, обладают спиновыми магнитными моментами.
Ответ следует, очевидно, искать в специфике атомного строения ферромагнитных веществ.
В атоме с достаточно большим порядковым номером вокруг ядра вращается значительное количество электронов. При вращении вокруг ядра электроны располагаются некоторыми слоями. Максимальное число электронов в слое (оболочке) равно 2n2, где n – порядковый номер слоя. Так, например, в первом слое электронов может быть всего 2, во втором слое 2·22, или 8, а в третьем 2·32, или 18, а в четвертом 32 электрона и т.п.
При переходе от одного атома к другому в порядке увеличения его атомного номера с меньшими порядковыми номерами и лишь потом начинают заполняться более отдаленные слои. Так, в атоме водорода всего один электрон, и он будет находиться в первом электронном слое. Атом гелия (его порядковый номер два) имеет два электрона, и они оба находятся в первом слое. У химического элемента лития, имеющего порядковый номер три, - три электрона. Эти электроны не могут быть размещены в первом слое, поскольку, как указывалось выше, максимальное количество электронов, которое может быть в первом слое, равно двум. Следовательно, третий электрон в атоме лития расположен во втором слое. У следующих по порядку элементов – бериллия, бора, углерода и т.д. – будет все больше и больше заполняться второй слой. У неона, имеющего порядковый номер десять, этот слой окажется полностью заполненным. Очевидно, у следующего элемента – натрия – начинает заполняться третий слой.
В слоях следует различать подслои. Первый подслой носит название s–подслоя и находящиеся в нем электроны называются s-электронами. Второй подслой называется p-подслоем, третий – d-подслоем, четвертый – f-подслоем. Соответственно этому имеем s, p, d, или f-электроны. Согласно квантовой теории, число электронов в каждом подслое должно быть ограничено. Так, в s-подслое их будет не более двух, в p-подслое – не более 6, в d-подслое – не более 10, в f-подслое число их не может превышать 14. Максимальное число электронов в слое равно 2n2, поэтому можно подсчитать также, какое число подслоев имеет каждый слой.
Первый слой, содержит всего 2 электрона, не имеет подслоев. Второй слой, который может иметь 8 электронов, имеет два подслоя: s-подслой (с двумя электронами) и p-подслой (с шестью электронами). Для обозначения того, в каком подслое какого слоя находится электрон, обозначают номер слоя числом, за которым ставят букву, обозначающую подслой. Например, запись 2s означает, что электрон принадлежит к первому подслою второго слоя, а запись 4d означает, что электрон принадлежит к третьему подслою четвертого слоя (таблица 1).
Таблица 1 - Максимальное число электронов в подслое каждого слоя
| Первый слой | Второй слой | Третий слой | Четвертый слой |
| 1 | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| 2 | 2 6 | 2 6 10 | 2 6 10 14 |
Последовательный характер заполнения слоев при переходе к химическим элементам с большими порядковыми номерами нарушается в третьем слое. Это значит, что наблюдаются случаи, когда третий слой еще не совсем заполнен, а уже начинает заполняться четвертый слой. Заметим, что у заполненных слоев и подслоев как орбитальные, так и спиновые магнитные моменты оказываются взаимно скомпенсированными, т.е. если направленные в одну сторону спины условно считать положительными, а в противоположную сторону – отрицательными, то число плюс и минус спинов окажется равным.
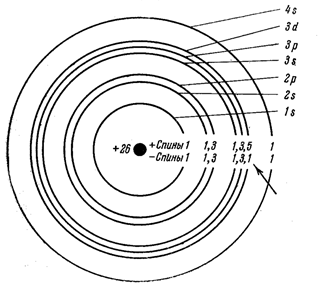
Рисунок 10 - Электронные слои и подслои в атоме железа.
На рисунке 10 схематически представлены электронные слои и подслои в атоме железа. Видно, что в атоме железа целиком заполнены первый и второй слои с одинаковым количеством + и – спинов в каждом. Одинаковое число + и – спинов находится также во внешнем, четвертом слое. Что же касается третьего слоя, то в нем целиком, с одинаковым числом + и – спинов, заполнены подслои 3s и 3p, а подслой 3d не заполнен и содержит 5 положительных спинов и 1 отрицательный.
Для других ферромагнетиков также характерно наличие внутренних незаполненных электронных слоев. Для железа, никеля и ?