Дипломная работа: Исследование твердых электролитов
Введение
Ионика твердого тела как область науки, лежащая на пересечении физики и химии твердого тела, электроники и электрохимии, кристаллографии и неорганической химии, материаловедения и энергетики получила широкое признание в последние 10-15 лет. В советском союзе начало исследованиям твердых электролитов было положено в 60-е годы в Институте электрохимии УрО РАН, Екатеринбург (школа акад. СВ. Карпачева; профессора В.Н. Чеботин, М.В. Перфильев и С.Ф. Пальгуев), СПбГУ (проф. А.Н. Мурин), МГУ (работы акад. Ю.Д. Третьякова), Институте новых химических проблем, Черноголовка (проф. Е.А. Укше, д-р хим. наук Н.Г. Букун), Институте электрохимии, Москва (канд. техн. наук B.C. Боровков, д-р хим. наук Ю.Я. Гуревич). В последние годы в связи с открытием большого числа новых материалов с высокой ионной проводимостью, созданием макетов полностью твердотельных топливных элементов, новыми теоретическими подходами к изучению явлений аномально быстрого ионного переноса в конденсированных средах и использованием новых мощных экспериментальных методик - в мире отмечается все более возрастающий интерес к суперионным проводникам и устройствам на их основе. Электролиты твёрдые, вещества, в которых электропроводность осуществляется движением ионов одного знака - катионами или анионами. Ионы передвигаются по свободным позициям в структуре в-ва, разделенным невысокими потенц. барьерами (0,1-0,5 эВ). Количество позиций, которые могут занимать ионы проводимости, намного больше кол-ва самих ионов. Кроме того, эти позиции могут различаться по степени заселенности ионами. Например, в элементарной ячейке![]() -Agl на 42 позиции приходятся 2 иона Ag+ , причем 12 тетраэдрит, позиций являются предпочтительными. Таким. образом, подрешетка ионов проводимости разупорядочена, в то время как остальные ионы твердых электролитов образуют жесткий каркас, и их перенос возможен по обычным механизмом образования точечных дефектов (вакансий и междоузельных ионов). Ионная составляющая
-Agl на 42 позиции приходятся 2 иона Ag+ , причем 12 тетраэдрит, позиций являются предпочтительными. Таким. образом, подрешетка ионов проводимости разупорядочена, в то время как остальные ионы твердых электролитов образуют жесткий каркас, и их перенос возможен по обычным механизмом образования точечных дефектов (вакансий и междоузельных ионов). Ионная составляющая![]() общей проводимости твердых электролитов, как правило, на 5-6 порядков больше электронной, т. е. числа переноса ионов проводимости практически равны 1. Коэф. диффузии Di этих ионов сравнимы с таковыми для конц. водных р-ров и соответствуют величинам порядка 10-5 - 10-6 см/с. твердые электролиты относят к суперионным проводникам и часто называют супериониками. Однако суперионик - более общее понятие, относящееся к высокопроводящим соединениям как с ионной проводимостью (электролиты твёрдые), так и со смешанной ионно-электронной проводимостью. В электрохимических системах суперионики со смешанной проводимостью выполняют роль электродов. Температурная зависимость ионной проводимости электролиты твёрдые
общей проводимости твердых электролитов, как правило, на 5-6 порядков больше электронной, т. е. числа переноса ионов проводимости практически равны 1. Коэф. диффузии Di этих ионов сравнимы с таковыми для конц. водных р-ров и соответствуют величинам порядка 10-5 - 10-6 см/с. твердые электролиты относят к суперионным проводникам и часто называют супериониками. Однако суперионик - более общее понятие, относящееся к высокопроводящим соединениям как с ионной проводимостью (электролиты твёрдые), так и со смешанной ионно-электронной проводимостью. В электрохимических системах суперионики со смешанной проводимостью выполняют роль электродов. Температурная зависимость ионной проводимости электролиты твёрдые![]() описывается ур-нием:
описывается ур-нием:
![]()
где А - константа, Т - абс. т-ра, Еа - энергия активации, k -константа Больцмана. Значение![]() и Еа для наиб, известных электролиты твёрдые приведены в таблице. Электролиты твёрдые подразделяются на электролиты с собственным структурным разупорядочением в одной из подрешеток и с примесным. К первым относятся в-ва, структура к-рых либо уже имеет пути проводимости для ионов определенного типа, как, напр., Na-
и Еа для наиб, известных электролиты твёрдые приведены в таблице. Электролиты твёрдые подразделяются на электролиты с собственным структурным разупорядочением в одной из подрешеток и с примесным. К первым относятся в-ва, структура к-рых либо уже имеет пути проводимости для ионов определенного типа, как, напр., Na-![]() -глинозем (полиалюминат натрия Na1+xAl11O17), либо приобретает их вследствие фазового перехода, как, напр., Agl (
-глинозем (полиалюминат натрия Na1+xAl11O17), либо приобретает их вследствие фазового перехода, как, напр., Agl (![]() -переход при 420 К). Пути проводимости могут иметь вид каналов [напр., в (C5H5NH)Ag5I6], щелей (напр., в Na-
-переход при 420 К). Пути проводимости могут иметь вид каналов [напр., в (C5H5NH)Ag5I6], щелей (напр., в Na-![]() -глиноземе) или трехмерных сеток (напр., в
-глиноземе) или трехмерных сеток (напр., в![]() -Agl). К электролиты твёрдые с примесным разупорядочением относятся твердые р-ры замещения, образующиеся в ионных кристаллах при легировании их ионами с валентностью, отличной от валентности основного иона. Возникающий при этом дефицит (или избыток) заряда компенсируется образованием дефектов противоположного знака. Так, в оксидах Zr, Hf, Се и Th, легир. оксидами двух- и трехвалентных металлов (Са, Y, Sc и др.), компенсация заряда примеси осуществляется кислородными вакансиями. Флюорит CaF2 и изоморфный ему SrF2 образуют твердые р-ры замещения с фторидами трехвалентных РЗЭ, обладающих высокой подвижностью ионов F- . Последние легко обмениваются на ионы О2- . Характерное свойство твердых электролитов - способность к замещению одних ионов проводимости на другие. Например, при выдерживании Na-
-Agl). К электролиты твёрдые с примесным разупорядочением относятся твердые р-ры замещения, образующиеся в ионных кристаллах при легировании их ионами с валентностью, отличной от валентности основного иона. Возникающий при этом дефицит (или избыток) заряда компенсируется образованием дефектов противоположного знака. Так, в оксидах Zr, Hf, Се и Th, легир. оксидами двух- и трехвалентных металлов (Са, Y, Sc и др.), компенсация заряда примеси осуществляется кислородными вакансиями. Флюорит CaF2 и изоморфный ему SrF2 образуют твердые р-ры замещения с фторидами трехвалентных РЗЭ, обладающих высокой подвижностью ионов F- . Последние легко обмениваются на ионы О2- . Характерное свойство твердых электролитов - способность к замещению одних ионов проводимости на другие. Например, при выдерживании Na-![]() -глинозема в расплаве AgNO3 ионы Na+ полностью замещены ионами Ag+. Если же Ag-b-глинозем поместить в р-р к-ты, то можно получить
-глинозема в расплаве AgNO3 ионы Na+ полностью замещены ионами Ag+. Если же Ag-b-глинозем поместить в р-р к-ты, то можно получить![]() глинозем с высокой проводимостью по протонам - ионам Н+ .
глинозем с высокой проводимостью по протонам - ионам Н+ .
Характеристика поликристалических твердых электролитов
| Электролит | Подвижный ион | Ea,эВ | |
| Ag+ | 337 (423 K) | 0,101a | |
| RbAg4I5 | Ag+ | 28 | 0,104 |
| Ag6WO4I4 | Ag+ | 4,2 | 0,248 |
| (C5H5NH)Ag5I6 | Ag+ | 21 (323 K) | 0,198б |
| Cs2Ag3Br3I2 | Ag+ | 0,1 | 0,38 |
| Cu4RbCl3I2 | Cu+ | 47 | 0,115 |
| Na2O x 10Al2O3e | Na+ | 3,3 | 0,140 |
| Na2O x 10Al2O3 | Na+ | 0,5 | 0,148 |
| Na3Zr2Si2Р012 | Na+ | 14 (573 K) | 0,246д |
| Nа3Sс2(РO4)3 | Na+ | 19 (573 K) | 0,144в |
| Na5DySi4O12 | Na+ | 0,50 | 0,208 |
| CsHSO4 | H+ | 1,8 (435 K) | 0,33ж |
| HUO2PO2 x 4H2O3 | H+ | 0,32 | 0,32 |
| H3PW12O40 x 19H2O3 | H+ | 1,20 | 0,432 |
| Cs3PW12O40 x 10H2O3 | H+ | 1,6 | 0,223 |
| Sb2O5 x 5,43H2O3 | H+ | 0,75 | 0,16 |
| 0,75Li4GeO4 x 0,25Li3PO4 | Li+ | 9,1 (573 K) | 0,42 |
| Sr0,8La0,2F2,2 | F- | 0,11 (573 K) | 0,196 |
| 0,91ZrO2 x 0,09Sc2O3 | O2- | 30 (1273 K) | 0,43 |
| (Bi2O3)0,8(SrO)0,2 | O2- | 0,6 (773 K) | 0,8 |
Протоно-проводящие электролиты твёрдые - в осн. кристаллогидраты твердых орг. и неорг. к-т и их солей, в к-рых перенос Н осуществляется либо по сетке водородных связей молекул Н2 О (механизм туннельного перехода), либо перемещением иона гидроксония Н3 О+ (прыжковый механизм), либо по молекулам, адсорбир. на межзеренных границах поликристаллич. материала. Исключение составляют безводные гидросульфаты и гидроселенаты щелочных металлов (напр., CsHSO4 и CsHSeO4 ), к-рые приобретают высокую ионную проводимость при т-рах выше структурного фазового перехода, когда число возможных мест локализации протонов оказывается вдвое больше числа самих протонов. Обладают протонной проводимостью и мн. полимерные структуры. Большинство Ag+-проводящих электролиты твёрдые получают либо выращиванием монокристаллов (![]() -Agl, RbAg4I5), либо твердофазным синтезом (RbAg4I5, (C5H5NH)Ag5I6 и др.). Для изготовления Li+-, Na+- и О2- -проводящих электролиты твёрдые используют технологию произ-ва керамики. Существуют полимерные электролиты твёрдые, к-рые обладают пластичностью, из них можно изготавливать тонкие пленки толщиной 0,5-250 мкм. По электропроводности они сравнимы с жидкими и твердыми электролитами (
-Agl, RbAg4I5), либо твердофазным синтезом (RbAg4I5, (C5H5NH)Ag5I6 и др.). Для изготовления Li+-, Na+- и О2- -проводящих электролиты твёрдые используют технологию произ-ва керамики. Существуют полимерные электролиты твёрдые, к-рые обладают пластичностью, из них можно изготавливать тонкие пленки толщиной 0,5-250 мкм. По электропроводности они сравнимы с жидкими и твердыми электролитами (![]() 1-10-3 См/м). Полимерные электролиты твёрдые - как правило, аморфные комплексы полимер-соль или полимер-к-та на. Получают их из полиэтиленоксида (ПЭО) и др. сходных по строению полимеров. Ион проводимости определяется природой второго компонента. При этом ион мигрирует вдоль полимерной цепи благодаря сегментальным движениям полимерной матрицы. Температурная зависимость проводимости комплексов удовлетворяет ур-нию, основанному на теории свободного объема:
1-10-3 См/м). Полимерные электролиты твёрдые - как правило, аморфные комплексы полимер-соль или полимер-к-та на. Получают их из полиэтиленоксида (ПЭО) и др. сходных по строению полимеров. Ион проводимости определяется природой второго компонента. При этом ион мигрирует вдоль полимерной цепи благодаря сегментальным движениям полимерной матрицы. Температурная зависимость проводимости комплексов удовлетворяет ур-нию, основанному на теории свободного объема:
![]()
где Т0 - идеальная т-ра стеклования полимера, Т - т-ра системы, В - константа.
В системе ПЭО-Н3 РО4 образуется комплекс (ПЭО) Н3 РО4 с n =1,33, обладающий протонной проводимостью ок. 10-3 См/м (298 К). В комплексе ПЭО-NH4 НSО4 анионы практически неподвижны и протон переносится катионами![]() (
(![]() 2 x 10-2 См/м). В комплексах ПЭО-LiС1О4 ток переносится как ионами Li+, так и
2 x 10-2 См/м). В комплексах ПЭО-LiС1О4 ток переносится как ионами Li+, так и![]() на подвижность к-рых оказывает влияние неполная диссоциация соли и образование ионных кластеров
на подвижность к-рых оказывает влияние неполная диссоциация соли и образование ионных кластеров![]() и
и![]() Аморфные структуры со св-вами электролиты твёрдые существуют и среди неорг. соединений. Это - стекла, представляющие собой трехмерные сетки, не имеющие строгой периодичности, но сохраняющие ближний порядок в расположении ионов. Такие структуры типа
Аморфные структуры со св-вами электролиты твёрдые существуют и среди неорг. соединений. Это - стекла, представляющие собой трехмерные сетки, не имеющие строгой периодичности, но сохраняющие ближний порядок в расположении ионов. Такие структуры типа![]() -RbAg4I5 обнаружены в смешанных галогенидных системах AgX-CsX и AgX-CuX-CsX (X = С1, Вr, I). Используют электролиты твёрдые в химических источниках тока, ионисторах, хим. сенсорах, в качестве ионселективных мембран, при термодинамич. исследованиях и др.
-RbAg4I5 обнаружены в смешанных галогенидных системах AgX-CsX и AgX-CuX-CsX (X = С1, Вr, I). Используют электролиты твёрдые в химических источниках тока, ионисторах, хим. сенсорах, в качестве ионселективных мембран, при термодинамич. исследованиях и др.
1. Общие сведения
В последние годы все большее внимание привлекают новые твердотельные ионопроводящие материалы (проводники второго рода) с высокой ионной проводимостью: их называют суперионными проводниками (СИП) или твердыми электролитами (ТЭЛ) (в англоязычной научной литературе — superionic conductors, solid electrolytes или fast ion conductors). Как известно, при нормальных условиях ионный перенос в обычных твердых телах — как кристаллических, так и аморфных — не очень значителен и при комнатной температуре проводимость, σ не превышает 10-10-10-12 Ом-1*см-1 [1].
Поскольку ионная проводимость имеет термоактиваиионный характер, то по мере увеличения температуры величина σ растет, однако даже в окрестности точки плавления она редко превышает 10-3Ом-1*см-1 (здесь не рассматриваются эффекты "предплавления" твердых тел, см., например, [2]). Однако аномально высокая ионная проводимость ТЭЛ наблюдается при температурах, существенно более низких, чем температура их плавления. На рис. 1.1 показана проводимость некоторых СИП в сравнении с обычными ионными кристаллами и жидкими электролитами.
Электропроводность "хороших" ТЭЛ составляет 10-1Ом-1*см-1 (при комнатной температуре!), что по порядку величины близко к проводимости расплавов и концентрированных растворов жидких электролитов. Таким образом, речь идет о материалах, сочетающих свойства жидкостей (проводимость, характерная для расплава или раствора, ионная термоЭДС) и твердых тел (механическая жесткость кристаллов).
Первые упоминания о высокой проводимости ионных кристаллов относятся, по-видимому, к началу XIX в., когда в 1833 г. Фарадей [3] отметил аномально высокую электропроводность сульфида серебра, сравнимую со значениями, σ для металлов. Через год, при исследовании фторида свинца, он обнаружил резкое изменение электропроводности кристалла при 450°С [4]; в настоящее время этот эффект известен как фарадеев (размытый) фазовый переход в кристаллах со структурой флюорита.
Первым оксидным ТЭЛ можно считать керамику состава (масс.%) 85ZrO2-l 5Y203, которую Нернст в 1899 г. использовал в качестве материала для ламп накаливания [5]. В 1914 г. при исследовании йодистого серебра Тубандт и Лоренц [6] обнаружили фазовый переход (при 147°С), в результате которого электропроводность скачком меняется более чем на три порядка, достигая величины 1*10-1*Ом*см-1 с последующим слабым ее повышением вплоть до плавления кристалла. Далее проводимость Agl даже слегка уменьшается (примерно на 7%). Следует отметить работы Каммера и Уэбера (1967 г.) [7,8], которые сообщили об электролитических свойствах глинозема и использовании этого материала в серно-натриевом аккумуляторе. В то же время Брэдли и Грин (и независимо от них) Оуэне и Агью [9,10] синтезировали новый серебропроводящий электролит RbAg4I5,проводимость которого при комнатной температуре долгое время была рекордно высокой (0,35 Ом-1* см-1). В настоящее время известно большое количество ТЭЛ, в которых проводимость обеспечивается самыми различными катионами — одно-, двух- и трехзарядными (Ag+, Cu+, Lн+, Na+, К+, Rb+ Тl+, Cs+, Ca2+, Zn2+, Mg2+, Pb2+,Al3+ Sc3+, Ce3+, Eu3+), а также анионами (F-, Сl-, Вr-, О2-, S2-).
Существуют материалы, где носителями зарядов служат одновременно ионы двух сортов, например, Ag2+ и Hg2+ в Ag2HgI4 или сокатионная проводимость в твердых растворах (N,К)-β-Аl2Оз; возможно, ионы трех сортов (К+, Rb+, Сs+) являются подвижными в системах [0,75(l-x)Rb0.7,К0.3FеО2]0,25ТiО2 [11].
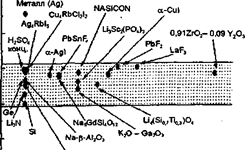
Рис. 1. Электропроводность наиболее интересных ионных проводников в сравнении с жидкими электролитами, полупроводниками, металлами и диэлектриками.
1.1 Основные положения теории дефектов в ионных кристаллах
Сложившиеся к началу XX столетия представления о твердых, телах как о кристаллических решетках, составленных из регулярно повторяющихся структурных единиц, не позволяли объяснить явления переноса вещества и электрического заряда в этих материалах.
Понятие о термических, точечных дефектах впервые было предложено в 1926 г. К.Ч Френкелем при рассмотрении механизма электропроводности ионных кристаллов [12]. При этом предполагалась, что в результате тепловых флуктуации часть катионов покидает свои нормальные места, переходя в междоузлия, образуя равное количество вакансий и "междоузельных катионов данного сорта. Такой тип дефектов впоследствии назвали "дефекты по Френкелю". Галогениды серебра AgCl и АgВr, нитраты щелочных металлов являются примером систем с преобладанием дефектов по Френкелю. Фториды щелочноземельных элементов (ЩЗЭ) обладают антифренкелевскими дефектами, т.е. в них при тепловом равновесии существуют равные количества вакансий анионов фтора и междоузельных анионов фтора. В 1935 г. В. Шоттки показал, что в ионных кристаллах может реализоваться такой предельный случай, когда равное число катионов и анионов уходит из нормальных мест в решетке на поверхность кристалла, создавая катионные и анионные вакансии и сохраняя при этом условие электронейтральности объема кристалла в целом [13]. Преобладающий тип дефектов по Шоттки имеют щелочногалоидные кристаллы.
Теоретически возможно существование антишоттковских дефектов равное количество катионов и анионов в междоузельных положениях, однако они пока не обнаружены ни в одной реальной кристаллической структуре.
Анализ большого числа стехиометрических ионных кристаллов позволяет сделать вывод, что наиболее распространенным типом разупорядоченности являются дефекты по Шоттки. Существование неконтролируемых примесных ионов или примеси (область малых концентраций), специально введенной в кристаллические объекты при легировании их в процессе выращивания, является также распространенным типом точечных дефектов.
Точечные дефекты термодинамически обратимы, поскольку их концентрация в твердом теле зависит от температуры и давления. Эти дефекты зачастую могут легко двигаться в кристалле посредством скачков атомов или ионов в междоузлиях либо в результате миграции вакансий, что эквивалентно смещению структурных элементов в направлении, обратному тому, в котором диффундируют дефекты. Очевидно, что явление переноса вещества тесно связано с существованием дефектов.
Теория точечных дефектов — одна из наиболее важных частей современной физической химии и физики твердого тела. Наличие точечных дефектов во многом определяет физико-химические свойства твердого тела, такие, как электропроводность ионных кристаллов, их оптические и полупроводниковые свойства, каталитическую активность, реакционную способность твердых тел и т.д.
Теория дефектов дает возможность количественно интерпретировать все физико-химические явления, связанные с существованием точечных дефектов в кристаллических твердых телах. Здесь рассмотрим лишь главные принципиальные концепции теории дефектов, которые, прежде всего, связаны с процессами переноса вещества в твердых телах. Основные положения теории дефектов были разработаны Френкелем, Иостом, Вагнером, Шоттки [12-15]. Затем эта теория была развита Хауффе, Вервеем и Лидьярдом, давшим возможность объяснить эффект влияния примесей на характер и степень разупорядоченности ионных кристаллических решеток [1, 16]. В 60-е годы значительный вклад в теорию точечных дефектов был сделан Крегером и Винком [17]. Впоследствии были обнаружены существенные ограничения в области применения термодинамической теории, так как стало известно, что структура дефектов в кристаллах с большой степенью отклонения от стехиометрии либо при повышенных концентрациях второй компоненты в смешанных кристаллах, как правило, более сложная, чем та, которая предполагается классической теорией точечных дефектов.
Однако необходимо подчеркнуть, что в большинстве случаев концентрация точечных дефектов даже при очень высоких температурах не превышает предельного значения. Это имеет место в случае галидов, сульфидов, оксидов металлов основных групп периодической системы, а также применимо к значительному количеству оксидов переходных металлов. Потому теория точечных дефектов является важной и постоянно развивающейся основой интерпретации экспериментальных результатов при изучении многих физнко-химических свойств твердых тел. В первом приближении можно ограничиться случаем невзаимодействующих дефектов, а затем учесть дальнодействуюшее кулоновское взаимодействие.
1.2 Основные положения физики и химии суперионных материалов
--> ЧИТАТЬ ПОЛНОСТЬЮ <--