Дипломная работа: Производство 12-дихлорэтана
Х3 (HCl) = 15,56•36,5/64,5=8,8 кг/ч
Определяем суммарное количество образовавшегося хлористого водорода:
![]()
На реакцию образования этилхлорида расходуется хлористого водорода – 10,1 кг/ч. остальное количество 94,2 – 8,8 = 85,4 кг/ч растворяется в дихлорэтане сырце.
Общий расход этилена.
![]()
![]()
Расход технического этилена.
Состав технического этилена, % об.:
Этилен (С2 Н4 ) – 99,9
Метан (СН4 ) – 0,048
Этан (С2 Н6 ) – 0,048
Пропилен (С3 Н6 ) – 0,005
Плотность при нормальных условиях [5]
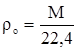
где М – молекулярная масса газа, кг/кмоль
![]() – плотность газа при н.у., кг/м3
– плотность газа при н.у., кг/м3
22,4 м3 – объем, занимаемый 1 кмоль газа.
![]() (С2 Н4 ) = 28/22,4 = 1,250 кг/м3
(С2 Н4 ) = 28/22,4 = 1,250 кг/м3
![]() (СН4 ) = 16/22,4 = 0,714 кг/м3
(СН4 ) = 16/22,4 = 0,714 кг/м3
![]() (С2 Н6 ) = 30/22,4 = 1,339 кг/м3
(С2 Н6 ) = 30/22,4 = 1,339 кг/м3
![]() (С3 Н6 ) = 42/22,4 = 1,875 кг/м3
(С3 Н6 ) = 42/22,4 = 1,875 кг/м3
![]() (С2 Н2 ) = 26/22,4 = 1,161 кг/м3
(С2 Н2 ) = 26/22,4 = 1,161 кг/м3
Объем при нормальных условиях [5]
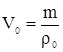
где ![]() – объем, занимаемый газом при н.у., м3
– объем, занимаемый газом при н.у., м3
m–масса газа, кг
![]() - плотность газа при н.у., кг/м3
- плотность газа при н.у., кг/м3
Объемный расход чистого 100%-ого этилена для получения дихлорэтана.