Дипломная работа: Термодинамика химической и электрохимической устойчивости медно-никелевых сплавов
Рис. 1.4. Диаграмма состояния Ni – O
Из рис. 1.4. следует, что при температурах ниже 200˚С в системе никель – кислород наблюдается следующая последовательность равновесий Ni | NiO | NiOx | NiO2 | {O2 }.
Здесь NiOx – фаза нестехиометрического состава, непрерывный ряд твёрдых растворов между NiO и NiO2 . 1<x<2.
1.7 Диаграммы рН – потенциал систем Cu – H 2 O и Ni – H 2 O
Диаграмма рН – потенциал системы Cu – H2 O приведена на рис. 1.5. Основные химические и электрохимические равновесия указаны в табл. 1.10.
Диаграмма рН – потенциал системы Ni – H2 O приведена на рис. 1.6. Основные химические и электрохимические равновесия указаны в табл. 1.11.
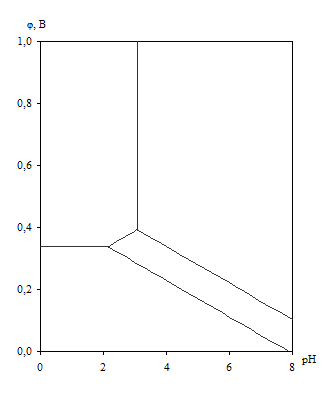
Рис. 1.5. Диаграмма рН – потенциал системы Cu – H2 O при 25о С, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов).
(негидратированная форма оксидов).
Табл. 1.10. Основные химические и электрохимические равновесия в системе Cu – H2 O при 25о С, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов)
(негидратированная форма оксидов)
|
№ линии |
Электродная реакция |
Равновесный потенциал (В) или рН раствора |
|
1 |
|
0,337 |
|
2 |
|
0,463–0,0591pH |
|
3 |
|
0,575–0,0591pH |
|
4 |
|
0,211+0,0591pH |
|
5 |
|
pH 3,08 |

Рис. 1.6. Диаграмма рН – потенциал системы Ni – H2 O при 25о С, ![]() атм. (возд
атм. (возд