Контрольная работа: Альдегиды и кетоны: общие сведения и способы получения
Фенолы и простые эфиры, а также нитробензол и все соединения с электро-ноакцепторными заместителями в реакцию Гаттермана-Коха не вступают.
Упр.5. Напишите схемы получения по реакции Фриделя-Крафтса:
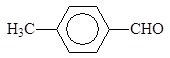
(а) пропиофенона; (б) бутирофенона; (в) бензофенона.
Упр.6. Напишите схемы получения ацетофенона: (а) окислением углеводо-рода, (б) окислением спирта, (в) гидролизом дигалогенуглеводорода, (г) ацилиро-ванием бензола.
Восстановление производных карбоновых кислот
Альдегиды можно получать восстановлением производных карбоновых кислот. Хлорангидриды кислот могут быть превращены в альдегиды восстановлением водородом в присутствии палладия, нанесенного на сульфат бария. Катализатор дезактивируют добавками хинолина с серой или тиомочевиной.
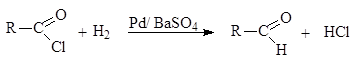
В современных методах в качестве восстановителей используют различные комплексные гидриды металлов. Одним из лучших восстановителей служит трис (трет-бутокси) гидроалюминат лития, образующийся при взаимодействии алюмогидрида лития с трет-бутиловым спиртом.
Эфиры и нитрилы карбоновых кислот восстанавливаются в альдегиды с помощью диизобутилалюминийгидрида.
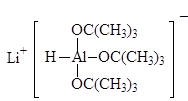
LiAlH(t-BuО) 3
 |
????(????-???????) ????????????? ????? ????????????????????????
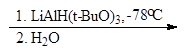 |
 (14)
(14)
Эфиры и нитрилы карбоновых кислот восстанавливаются в альдегиды с помощью диизобутилалюминийгидрида.
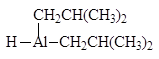
(DIBAL-H)
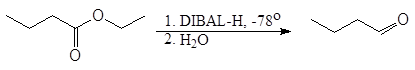 (15)
(15)
Литийдиалкилкупратный метод получения кетонов
При действии литийдиалкилкупрата на хлорангидриды карбоновых кислот в эфире при охлаждении образуются кетоны:
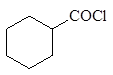 |
![]()
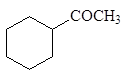 (16)
(16)
Упр.7. Напишите реакции, приводящие к следующим превращениям:
(а) бензол ® бромбензол ® фенилмагнийбромид ® бензиловый спирт ® бензальдегид; (б) толуол ® бензойная кислота ® бензоилхлорид ® бензальдегид;
(в) этилбромид ® 1-бутин ® 2-бутанон; (г) 2-бутин ® 2-бутанон; (д) 1-фенилэтанол ® ацетофенон. (е) бензоилхлорид ® ацетофенон; (ж) бензойная кислота ® ацетофенон; (з) бензилбромид ® С6Н5СН2СN ® 1-фенил-2-бутанон;
(и) С6Н5СН2СN ® 2-фенилэтаналь: (з) метилкапронат ® гексаналью
В результате взаимодействия альдегидов и кетонов с углеродными нуклеофила-ми образуются новые связи С¾С. Такими нуклеофилами служат реактивы Гриньяра, литийорганические соединения, ацетилениды и циановодородная кислота.
![]()
![]()
![]()
![]()
А. Присоединение реактивов Гриньяра.
Особая ценность реактивов Гриньяра заключается в их способности создавать новые связи С¾С. Разница в электроотрицательности между углеродом и магнием (2,5 - 1,2 = 1,3), обусловливает полярность связи между этими атомами и наличие частичного отрицательного заряда на атоме углерода и частичного положительно-го заряда на атоме магния. В реакциях реактивы Гриньяра ведут себя как карбанионы. Карбанионы являются хорошими нуклеофилами и легко присоединяются к карбонильной группе. Магнийорганические соединения вступают в реакции нуклеофильного присоединения к альдегидам и кетонам с образованием алкоксидов, гидролизующихся в спирты:
Присоединение к формальдегиду приводит к образованию первичных спиртов.
