Контрольная работа: Методы получения дисперсных систем
Из уравнения (6) следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция (1) протекает самопроизвольно при постоянных Р и Т или V и Т, то значения G и этой реакции можно получить из уравнения:
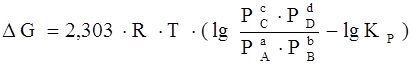 , (7)
, (7)
где Р А , Р В , Р С , РD – парциальные давления исходных веществ и продуктов реакции.
Уравнение (7) называются уравнениями изотермы химической реакции Вант-Гоффа. Это соотношение позволяет рассчитать значения G и F реакции, определить ее направление при различных концентрациях исходных веществ.
Необходимо отметить, что как для газовых систем, так и для растворов, при участии в реакции твердых тел (т.е. для гетерогенных систем) концентрация твердой фазы не входит в выражение для константы равновесия, поскольку эта концентрация практически постоянна. Так, для реакции
2 СО (г) = СО 2 (г) + С (т)
константа равновесия записывается в виде
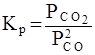 .
.
Зависимость константы равновесия от температуры (для температуры Т2 относительно температуры Т1 ) выражается следующим уравнением Вант-Гоффа:
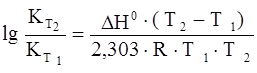 , (8)
, (8)
гдеН0 – тепловой эффект реакции.
34. Осмос, осмотическое давление. Уравнение Вант-Гоффа и осмотический коэффициент.
Осмос – самопроизвольное движение молекул растворителя через полупроницаемую мембрану, разделяющую растворы разной концентрации, из раствора меньшей концентрации в раствор с более высокой концентрацией, что приводит к разбавлению последнего. В качестве полупроницаемой мембраны, через маленькие отверстия которой могут селективно проходить только небольшие по объему молекулы растворителя и задерживаются крупные или сольватированные молекулы или ионы, часто служит целлофановая пленка – для высокомолекулярных веществ, а для низкомолекулярных – пленка из ферроцианида меди. Процесс переноса растворителя (осмос) можно предотвратить, если на раствор с большей концентрацией оказать внешнее гидростатическое давление (в условиях равновесия это будет так называемое осмотическое давление, обозначаемое буквой ). Для расчета значения в растворах неэлектролитов используется эмпирическое уравнение Вант-Гоффа:
= C · R · T,
где С – моляльная концентрация вещества, моль/кг;
R – универсальная газовая постоянная, Дж/моль · К.
Величина осмотического давления пропорциональна числу молекул (в общем случае числу частиц) одного или нескольких веществ, растворенных в данном объеме раствора, и не зависит от их природы и природы растворителя. В растворах сильных или слабых электролитов общее число индивидуальных частиц увеличивается вследствие диссоциации молекул, поэтому в уравнение для расчета осмотического давления необходимо вводить соответствующий коэффициент пропорциональности, называемый изотоническим коэффициентом.
i · C · R · T,
где i – изотонический коэффициент, рассчитываемый как отношение суммы чисел ионов и непродиссоциировавших молекул электролита к начальному числу молекул этого вещества.
Так, если степень диссоциации электролита, т.е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, равна и молекула электролита распадается при этом на n ионов, то изотонический коэффициент рассчитывается следующим образом:
i = 1 + (n – 1) · ,(i > 1).
Для сильных электролитов можно принять = 1, тогда i = n, и коэффициент i (также больше 1) носит название осмотического коэффициента.
Явление осмоса имеет большое значение для растительных и животных организмов, поскольку оболочки их клеток по отношению к растворам многих веществ обладают свойствами полупроницаемой мембраны. В чистой воде клетка сильно набухает, в ряде случаев вплоть до разрыва оболочки, а в растворах с высокой концентрацией солей, наоборот, уменьшается в размерах и сморщивается из-за большой потери воды. Поэтому при консервировании пищевых продуктов к ним добавляется большое количество соли или сахара. Клетки микроорганизмов в таких условиях теряют значительное количество воды и гибнут.
Осмотическое давление обеспечивает движение воды в растениях за счет различия осмотических давлений между клеточным соком корней растений (5-20 бар) и почвенным раствором, дополнительно разбавляемом при поливе. Осмотическое давление обусловливает в растении подъем воды от корней до вершины. Таким образом, клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние берут ее из клеток корня.
49. Рассчитать ЭДС медно-цинкового гальванического элемента, в котором концентрация ионов С u 2 + равна 0,001 моль/л, а ионов Zn 2+ 0,1 моль/л. При расчетах учтите стандартные значения ЭДС:
εо (Zn 2+ /Zn 0 ) = – 0,74 В и εо (Cu 2 + /Cu0 ) = + 0,34 В.
Для расчета величины ЭДС используется уравнение Нернста 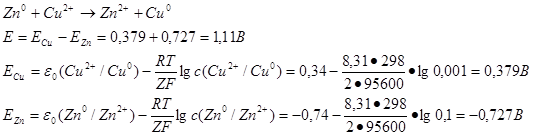
54. Методы получения дисперсных систем, их классификация и краткая характеристика. Какой метод получения дисперсных систем с термодинамической точки зрения наиболее выгоден?