Контрольная работа: О растворах
Наблюдаемые отклонения в свойствах растворов сильных электролитов связаны с сильным электростатическим взаимодействием ионов в растворе. Каждый ион окружён «ионной атмосферой» из ионов противоположного знака, которая влияет на его подвижность и вызывает отклонение свойств от ожидаемых величин.
Для характеристики растворов сильных электролитов вместо их истинной концентрации используют активность ( ![]() ), т.е. условную эффективную концентрацию в соответствии с которой они проявляют себя в химических и физических процессах.:
), т.е. условную эффективную концентрацию в соответствии с которой они проявляют себя в химических и физических процессах.:
![]()
где ![]() – коэффициент активности;
– коэффициент активности;
с – истинная концентрация.
Коэффициенты активности определяется экспериментально и приводится в таблицах. Для разбавленных растворов электролитов ![]() не зависит от природы иона и может быть рассчитан по формуле:
не зависит от природы иона и может быть рассчитан по формуле:
![]()
где I– ионная сила раствора, которая определяется по формуле:
![]()
b(X) – моляльные концентрации ионов
z– заряды ионов.
Для предельно разбавленных растворов, в которых практически отсутствует взаимодействие между ионами, ![]() = с,и
= с,и ![]()
7. Электролитическая диссоциация воды. Водородный показатель
Вода является слабым электролитом, который диссоциирует по уравнению: ![]() .
.
Это явление называется самоионизацией или автопротолизом.
Константа диссоциации воды при 250 С составляет:
![]()
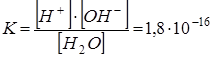
Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
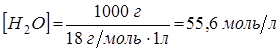
Тогда:
![]()
![]() (при 295 К)
(при 295 К)
Величина Kw называется ионным произведением воды.
Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной.
Кислотность или основность водного раствора может быть выражена концентрацией ионов водорода или гидроксид-ионов. Чаще всего для этой цели используют величину рН, которая связана с концентрацией ионов водорода следующим соотношением:
![]()
В нейтральной среде:
![]() ; рН = 7
; рН = 7
В кислой среде: