Контрольная работа: Полевая форма материи
Исследование структуры атома поставило вопрос о том, что представляет собой ядро, какова его структура. В ядре сосредоточена почти вся масса атома (масса электронов, входящих в атом, пренебрежительно мала по сравнению с массой ядра), оно имеет положительный заряд, эквивалентный суммарному заряду входящих в него электронов. Заряд ядра любого элемента равен его порядковому номеру в периодической системе элементов. Проблема структуры атомного ядра получила разрешение с открытием в 1932 году Д. Чедвиком нейтрона - третьей элементарной частицы после электрона и протона. Масса нейтрона близка к массе протона. Электрический заряд у ядра отсутствует. Д.Д. Иваненко сформулировал протонно-нейтронную концепцию строения атомного ядра, которую затем разработал В. Гейзенберг. Ядра, состоящие из протонов и нейтронов, получили название нуклонов. В том же 1932 году в космических лучах К. Андерсоном был открыт позитрон - положительно заряженный электрон, обеспечивший симметрию между положительным и отрицательным зарядами во взаимоотношениях частиц. Его существование было предсказано П. Дираком, исходившим из того, что положительные заряды во Вселенной представляют собой своего рода недостающие части мирового отрицательного заряда - позитрон есть "дырка" в распределении электронов с отрицательной энергией. Столкновение электрона и позитрона приводит к аннигиляции - их превращению в два фотона, испускаемые в противоположных направлениях.
Из всех названных частиц нейтрон оказался наиболее пригодным для осуществления процесса ядерного превращения, поскольку ввиду отсутствия у него заряда он способен глубже проникнуть в вещество, входить в положительно заряженные ядра атомов, которые отталкивают положительно заряженные протоны и альфа-частицы. Благодаря этому в краткий срок было изучено действие нейтронов на различные ядра, что привело к открытию искусственной радиоактивности. Решающее достижение в этой области принадлежит Ф. Жолио Кюри и И. Кюри, установившим, что почти все подвергнутые бомбардировке атомы становятся радиоактивными. Это означало, что естественная радиоактивность является лишь остаточной активностью атомов, которые еще не успели достичь устойчивых состояний. Знание атомных превращений могло помочь объяснить, каким образом возникли элементы.
Начавшееся с 30-х гг. ХХ века создание ускорителей дало возможность повысить эффективность исследований в этой области. Х.А. Бете и Г.А. Гамов способствовали установлению вероятных циклов термоядерных реакций, являющихся источниками внутризвездной энергии. Стало ясно, что источником большей части энергии Вселенной являются ядерные процессы. Встала задача выяснения механизма высвобождения этой энергии. Э. Ферми, подвергнув бомбардировке нейтронами тяжелые элементы, обнаружил огромную эффективность медленных нейтронов. О. Ган и Ф. Штрасман открыли деление ядер урана под действием нейтронов. О. Ган и Л. Мейтнер исследовали продукты распада облученного урана и отыскали среди них элементы до атомного номера 96. Деление ядер стало установленным фактом.
5. Опишите модификации углерода. Почему столь многообразны соединения углерода? Какие особенности строения атома углерода определили его роль в живой природе?
Углерод (лат. Carboneum), С - химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12 С (98,892%) и 13 С (1,108%).
Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз - как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей и карандашей.
Углерод имеет четыре основных аллотропных модификации: алмаз, графит, карбин и фуллерен.
Алмаз - кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; Т°пл. = 3730 °C; Т°кип = 4830 °C. В структуре алмаза каждый атом углерода находится в состоянии sp3-гибридизации и имеет четырех соседей, которые расположены в вершинах правильного тетраэдра, весь кристалл представляет собой трехмерный каркас, с этим связана высокая твердость алмаза, самая высокая среди природных веществ. Кристаллизуется в виде двух полиморфных модификаций - кубической и гексагональной.
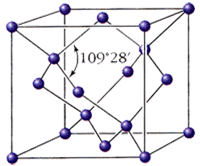 | 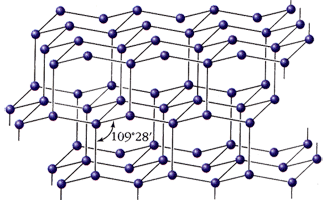 |
| Алмаз кубический | Алмаз гексагональный |
Графит - мягкое вещество серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток; ρ = 2,5 г/см3. Атомы углерода находятся в состоянии sp2-гибридизации и связаны в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие пчелиных сот. Каждый атом в слое имеет трех соседей, для образования трех ковалентных связей атом предоставляет три электрона, а четвертый электрон образует p-связь и делокализован по всему кристаллу.
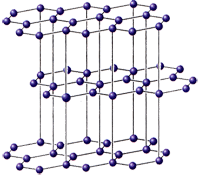
Этим объясняется способность графита расщепляться на тонкие чешуйки, которые очень прочны, его металлический блеск, тепло - и электропроводность. Графит - наиболее устойчивая при комнатной температуре аллотропная модификация углерода.
Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры , а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О, Н - составляют 98% общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась р?