Контрольная работа: Применение потенциометрического и кулонометрического методов анализа в фармации и аналитической химии
1. Смешаны 400 мл 0,0405 моль/л раствора бромата калия и 250 мл раствора бромата калия с молярной концентрацией эквивалента KВrO3 0,222 моль/л. Объем смеси разбавлен водой до 1000 мл. рассчитать молярную концентрацию эквивалента полученного раствора.
![]() 400мл – 0,0405 моль/л Ход решения:
400мл – 0,0405 моль/л Ход решения:
250мл – 0,222 моль/л Первым делом определим, сколько молей вещест-
![]() ва содержится в 400 мл раствора и в 250 мл.
ва содержится в 400 мл раствора и в 250 мл.
0,0405 моль – в 1000 мл
х - в 400 мл, следовательно
х=0,0405*400/1000=0,0162 моль
0,222 моль – в 1000 мл
у - в 250 мл
у=0,222*250/1000=0,0555 моль
Значит, в растворе будет содержатся 0,0162+0,0555=0,0717 моль вещества.
Поскольку раствор разбавляют водой до 1000мл (1л), получим, что молярная концентрация полученного раствора составит 0,0717 моль/л.
Теперь определим молярную концентрацию эквивалента полученного раствора.
Сн =nэ /Vp - pa , в свою очередь
nэ= m/Mэ, где Mэ – молярная масса эквивалента.
Молярная масса эквивалента соли определяется отношением молярной массы соли к произведению чиста атомов металла на его валентность. Поскольку К одновалентен и в данной соли содержится всего один его атом, следовательно Mэ =М, а значит молярная концентрация и молярная концентрация полученного раствора будут равны. Т.е. молярная концентрация эквивалента полученного раствора равна 0,0717 моль/л.
Ответ: 0,0717 моль/л.
2. Применение потенциометрического и кулонометрического методов анализа в фармации и аналитической химии.
Потенциометрический метод – это метод качественного и количественного анализа, основанный на измерении потенциалов, возникающих между испытуемым раствором и погруженным в него электродом. Данный метод рекомендуется для установления доброкачественности и количественного анализа некоторых фармакопейных препаратов. Использую потенциометрическое титрование, можно более объективно устанавливать точку эквивалентности, поэтому метод находит широкое практическое применение. Одним из направления потенциометрического метода является хронопотенциометрия. Сущность этого метода заключается в том, что потенциал одного их электродов записывают как функцию времени. Помимо аналитических целей метод может быть использован для изучения кинетики химических процессов. Потенциометрический метод также может быть использован при исследовании процессов разрушения лекарственных веществ при хранении.
Кулонометрический метод весьма перспективен для анализа лекарственных веществ: некоторых местноанестезирующих средств, сульфаниламидов, алкалоидов. Кулонометрический метод основан на законе Фарадея, устанавливающем связь между количеством вещества, выделившегося на электродах, и затраченным на этот процесс количеством электричества.
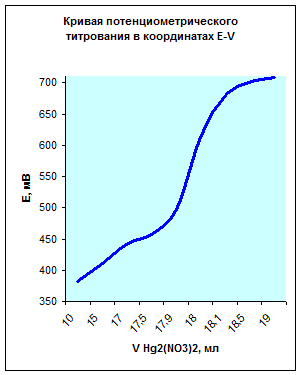
3. Построить кривые потенциометрического титрования в координатах E-V и ∆E/∆V-V и рассчитать концентрацию хлорида кальция в растворе (г/л), если при титровании 20,0 мл анализируемого раствора 0,0500 н. раствором Hg2 (NO3 )2 получили следующие данные:
| V Hg2 (NO3 )2 , мл | 10,0 | 15,0 | 17,0 | 17,5 | 17,9 | 18,0 | 18,1 | 18,5 | 19,0 |
| Е, мВ | 382 | 411 | 442 | 457 | 498 | 613 | 679 | 700 | 709 |
По данным таблицы получим следующую кривую потенциометрического титрования в координатах E-V:
| V Hg2 (NO3 )2 , мл | 10,0 | 15,0 | 17,0 | 17,5 | 17,9 | 18,0 | 18,1 | 18,5 | 19,0 |
| ∆E/∆V | 5,8 | 15,5 | 30 | 102,5 | 1150 | 660 | 52,5 | 18 |
Исходя из данных этой таблицы получим следующий график:
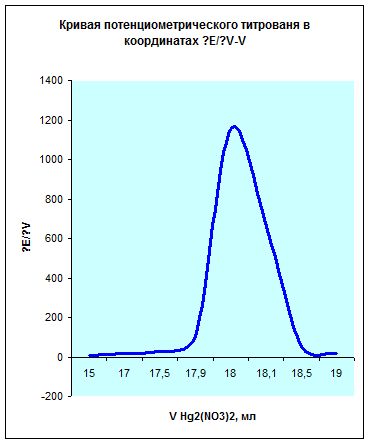
Из данных графиков видно, что точка эквивалентности соответствует 18мл Hg 2 ( NO 3 )2. Отсюда можно рассчитать концентрацию хлорид кальция в растворе.
Уравнение реакции имеет следующий вид:
CaCl2 + Hg2 (NO3 )2 ® Hg2 Cl2 +Ca(NO3 )2
m(Hg2 (NO3 )2 )=Cн(Hg2 (NO3 )2 )*Mэ(Hg2 (NO3 )2 )*V(Hg2 (NO3 )2 )
Нормальность данного раствора дана в условии задачи, объем определили по графику, осталось рассчитать Mэ.
Молярная масса эквивалента соли равна отношению мольной массы соли к произведению числа атомов металла на его валентность. Т.е., получим:
--> ЧИТАТЬ ПОЛНОСТЬЮ <--