Контрольная работа: Производство азотной кислоты
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
1. Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3 ) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3 . Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3 ·Н2 О и HNO3 · 3Н2 О, которые дают три эвтектики (рис. 1.1).
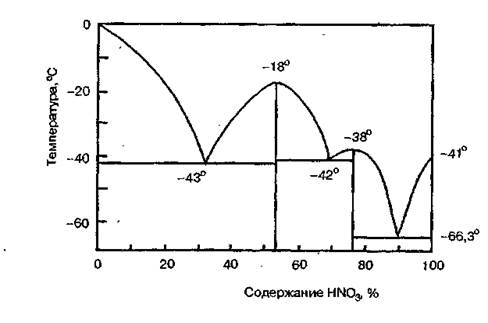
Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2 »
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.
![]()
Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2 О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:
![]()
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3 ·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).

Рис. 1.4. Области применения азотной кислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 2.1.

Рис. 2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
--> ЧИТАТЬ ПОЛНОСТЬЮ <--
