Курсовая работа: Блистающий мир белков и пептидов
N = 20n .
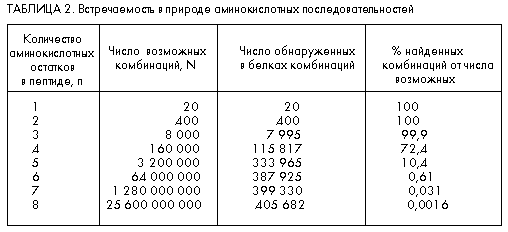
Из этой формулы следует, что максимальное число разных дипептидов (n = 2) равно 400, трипептидов (n = 3) – 8000, тетрапептидов (n = 4) – 160 000 и т.д. Как видим (см. табл. 2), число N очень быстро растет с увеличением n.
Тогда возникает другой вопрос: а каковы возможности живого организма вмещать в себя подобную информацию? Первичная информация содержится в нуклеотидной последовательности, и хотя она и очень велика, но все же не беспредельна. В табл. 3 представлены числа азотистых оснований суммарной ДНК у представителей разных царств живой природы. Первое, на что обращаешь внимание, это то, что общее их число варьирует в очень широких пределах и может составлять от 107 (некоторые бактерии и грибы) до 1011 (представители растений и рыб). При этом заметим, что царь природы человек отнюдь не является чемпионом среди других представителей живой природы, довольствуясь лишь примерно одним миллиардом азотистых оснований. Но для нас главное не это. Оказывается, самый большой геном не может вместить информацию даже о всех возможных декапептидах (n = 10) при их последовательном расположении.
Действительно, при n = 10:
N = 6,7х1011 .
Eсли учесть то, что для записи одного аминокислотного остатка требуется 3 азотистых основания и что часть генома, шифрующая аминокислотные последовательности, составляет только несколько процентов от его общей величины, то получается, что самый большой геном способен вместить информацию о последовательности, состоящей лишь из 109 аминокислотных остатков. Таким образом, в нем может содержаться информация менее чем об 1% всех возможных декапептидов. А ведь известны белки, содержащие более 5 тыс. аминокислотных остатков!

Отсюда следует вывод о том, что в природе встречаются далеко не все линейные комбинации аминокислотных остатков. Это подтверждается компьютерным анализом встречаемости различных линейных комбинаций аминокислотных остатков во всех расшифрованных белках и пептидах (более 100 тыс.). Полученные результаты приведены в табл. 2, данные которой свидетельствуют о том, что в случае уже октапептидов (N = 8) встречается всего лишь около 0,001% возможных линейных комбинаций аминокислотных остатков.
А способна ли математика ответить на вопрос, решенный лингвистикой: можно ли дать строгое определение разницы между малыми и большими пептидами (олигопептидами и полипептидами)?
Попробуем на него ответить, пользуясь рассуждениями нашего великого соотечественника математика Андрея Николаевича Колмогорова (1903–1987), о малых (S) и больших (G) числах, свидетелем которых автор был на семинаре в МГУ в 1958 г. Колмогоров рассуждал примерно так. Числа существуют в определенной системе счисления. Система счисления, которой пользуется подавляющая часть человечества, определяется величиной m = 10. Тогда в рамках этой десятичной системы малыми числами будут такие, которые удовлетворяют условию m > S > m, а большие – G >> m. Иными словами, малые числа по порядку величины сравнимы с величиной основания системы счисления, а большие – во много раз ее больше.
К олигопептидам и белкам эти рассуждения можно применить таким образом. Еще раз отметим то, что эти вещества формируются из 20 различных аминокислотных остатков, а обычно используемые числа образуются из 10 разных цифр. Следовательно, аналогом числовой системы счисления в нашем случае является аминокислотная система счисления, характеризующаяся величиной 20, и тогда малыми (олигопептидами) можно считать такие, в которых содержится меньше или больше 20 аминокислотных остатков (20 > n > 20), а большие – у которых их много больше 20, (n >> 20). Этот критерий является чисто математическим, но, однако, его можно увидеть и в физических, и в биологических свойствах олигопептидов и белков. Но об этом будет рассказано в последующих разделах.
Физика
Ключевыми в физике являются понятия: взаимодействия, энергия и энтропия (энтропия – мера неупорядоченности, соответственно, отрицательная энтропия – мера упорядоченности). При физическом взгляде на мир белков и олигопептидов такие понятия также весьма полезны. Молекулы этих веществ осуществляют взаимодействия как внутри себя, так и с внешними молекулами. Эти взаимодействия направлены на приобретение отдельными молекулами или молекулярными комплексами определенной пространственной формы (конфигурации или конформации), что в конкретных условиях приводит к достижению минимально возможной энергии при данной степени неупорядоченности. А многообразие возможных аминокислотных последовательностей лежит в основе неизмеримо большего многообразия их возможных пространственных (уже не линейных) конфигураций.
Как сравнительно просто устроена ДНК! Для выявления общей конфигурации ее двойной спирали в начале 1950-х гг. прошлого века Уотсону и Крику, любившим обсуждать научные проблемы за чашечкой кофе, потребовалось выпить не очень много литров этого тонизирующего напитка, чтобы разобраться в принципах ее организации. Так же немного времени (всего несколько лет) потребовалось на то, чтобы в 1960-х гг. описать, как последовательность азотистых оснований ДНК и РНК транслируется (переводится) на язык аминокислотных остатков. Казалось бы, еще немного (допустим, не более 10 лет), и общие принципы формирования пространственной структуры белков будут найдены! Эта проблема получила название проблемы фолдинга (от англ. fold – складывать). Однако нет. Прошло уже почти 40 лет после начала экспериментального получения пространственных структур белков, а тайна пока не раскрыта. Тысячи ученых разных специальностей в течение этого времени (некоторые – всю свою творческую жизнь) пытались создать универсальный метод построения пространственной структуры белков по аминокислотной последовательности (как это делается в природе), но никому данную проблему не удалось решить даже для одной не слишком протяженной структуры. Почему?
В отличие от ДНК или РНК, составленных всего из 4 стандартных азотистых оснований, белки включают 20 стандартных аминокислотных остатков. Это приводит к тому, что число возможных взаимодействий пар остатков (как соседствующих, так и удаленных) оказывается более чем на порядок больше, чем для пар азотистых оснований. А в пространстве могут взаимодействовать одновременно не 2, а более остатков, в результате чего число возможных взаимодействующих единиц на много порядков больше. Важным является то, что весь остов транслированной пептидной цепи является прочным, поскольку все его элементы, включая и пептидную связь, объединены сильными химическими (ковалентными) связями. Химическая связь между удаленными аминокислотными остатками бывает, как правило, только одного типа в случае, когда два остатка цистеина образуют дисульфидную связь (S-S связь, или S-S мостик). Это существенно уменьшает число возможных конфигураций. Однако и при наличии S-S связей у протяженных полипептидов остается еще много степеней свободы для образования разных конфигураций, и, кроме того, существует немало белков, в которых остатки цистеина отсутствуют.
Следует учитывать и то, что характер взаимодействий этих сближенных аминокислотных остатков разный, поскольку одни из них являются заряженными, что приводит к электростатическому взаимодействию, другие (полярные) способны участвовать в дипольных и еще более сложные взаимодействиях. Сблизившимся плоским циклическим группам для достижения минимальной энергии выгодно занять плоско-параллельное положение, и это приводит к стэкинг(стопочному)-взаимодействию, а неполярным (гидрофобным) группам из тех же соображений выгодно выйти из полярного окружения (водной среды), сблизиться и объединиться друг с другом (гидрофобные взаимодействия).
Все эти взаимодействия намного слабее ковалентных связей. А еще существуют водородные связи, энергия которых также мала, но при большом их числе они могут кардинально изменить общую конфигурацию молекулы и придать ей пространственно регулярную форму вторичной структуры (спирали, слоя, шпильки). В результате осуществления всех типов слабых взаимодействий в белках могут формироваться сложнейшие пространственные образования (третичная структура). На рис. 1 приведен пример такой третичной структуры сывороточного альбумина быка, состоящего из 607 аминокислотных остатков (без цистеинов, т.е. без S–S-связей), и полученной в результате применения сложнейшего экспериментального физического метода, называемого рентгеноструктурным анализом. У этой молекулы можно увидеть и спирали, и сближение этих спиралей, и группы различных субмолекулярных образований (доменов), и просто связующие участки. Такая компактная молекула имеет форму глобулы (от лат. globules – шарик) и поэтому называется глобулярной структурой.

Рис. 1. Третичная (пространственная) структура сывороточного альбумина, состоящего из 607 аминокислотных остатков
Существуют также фибриллярные белки (от лат. fibra – волокно), которые сильно вытянуты (например, мышечный белок миозин).
Но как ни сложна показанная на рисунке пространственная структура, она еще не самая сложная. Можно представить себе, сколько дополнительных проблем для теоретического (и экспериментального) анализа возникает при рассмотрении не одной, а двух или более взаимодействующих белковых молекул (четвертичная структура).
Казалось бы, в случае олигопептидов все должно быть проще и доступнее для анализа (и теоретического, и экспериментального). Однако это не так. И тут мы подошли к обещанному физическому определению различия между поли- и олигопептидами.
Связи между аминокислотными остатками (за исключением ковалентных) по энергии много меньше химических, отражают сущность физических процессов и поэтому называются физическими (в общем смысле они уже являются не связями, а взаимодействиями).
Каждое отдельное из этих взаимодействий является непрочным, может образовываться и распадаться, т.е. характеризоваться каким-то временем существования. Однако при увеличении длины пептидной цепи число таких одновременных взаимодействий возрастает, и с достижением некоторой длины их суммарное действие приводит к тому, что молекула принимает все более стабильную конфигурацию.
Из термодинамических исследований следует, что эта длина составляет около 50 аминокислотных остатков и может быть меньше или больше в зависимости от конкретной аминокислотной последовательности, т.е. от присутствия и расположения разных взаимодействующих элементов.
Таким образом, физические данные согласуются с теми, которые были нами получены из математических рассуждений, поскольку число 50 является величиной того же порядка, что и 20, характеризующее «аминокислотную систему счисления». Поэтому олигопептиды – вещества с числом аминокислотных остатков порядка 50, а у полипептидов (белков) это число много больше 50.
Итак, поскольку число аминокислотных остатков у олигопептидов мало, а следовательно, и внутримолекулярных взаимодействий у них недостаточно для образования стабильной пространственной структуры, то их конфигурация постоянно изменяется в масштабах времени микромира (в нашем временном масштабе их можно сравнить с извивающимся червяком, выползшим на поверхность во время сильного дождя).
Одним из следствий таких постоянных и быстрых изменений является то, что из этих молекул трудно (или невозможно) получить кристаллы и вследствие этого исследовать с помощью рентгеноструктурного анализа. Правда, существует еще один мощный метод (ядерный магнитный резонанс, ЯМР), с помощью которого удается получить целые наборы конфигураций. Однако и в этом методе требуется использование сильно концентрированных растворов пептидов, в такой системе уже может осуществляться межмолекулярное взаимодействие одинаковых молекул пептидов друг с другом, что влияет на получающийся результат и фиксирует конфигурацию (конформацию) не только отдельной, но и взаимодействующей с другими пептидной молекулы.