Курсовая работа: Блистающий мир белков и пептидов
На рис. 2 показаны 4 возможные структуры природного пептидного опиоида энкефалина, состоящего из 5 аминокислотных остатков. Насколько они разные! Первая (развернутая) с большим трудом была получена с помощью рентгеноструктурного анализа. Три другие рассчитаны с применением специальных методов компьютерного моделирования, в результате чего получены структуры, содержащие от одной до трех внутримолекулярных водородных связей и очень сильно отличающиеся по конфигурации. Малость молекулы олигопептида позволяет ей в живом организме перемещаться на довольно большие расстояния, а высокая внутримолекулярная подвижность – принимать форму, необходимую для успешного взаимодействия со многими веществами, в том числе и с крупными белками (например, с рецепторами).
Биология
Многообразие структурных форм белков и олигопептидов лежит в основе многообразия и их биологических функций. Это многообразие обусловливает то, что единой и строгой классификации веществ пептидной природы не существует, и пока есть сомнения в том, что такую классификацию в ближайшее время можно будет создать. Поэтому представляется возможным лишь грубо и далеко неполно охарактеризовать лишь часть структурно-функциональных групп белков, что и представлено в табл. 4.
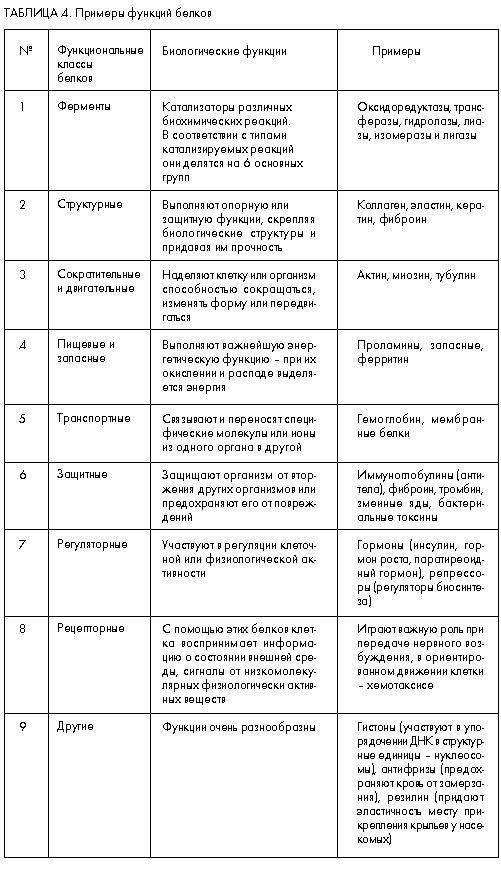
Функциональные свойства белков изучаются уже довольно давно, еще даже до тех времен, когда научились определять их аминокислотную последовательность. Многие из этих свойств широко известны, в том числе вошли и в школьные учебники. Поэтому нам кажется целесообразным более подробно охарактеризовать биологические свойства олигопептидов, которые начали изучать сравнительно недавно. А в отношении белков отметим лишь одну, но принципиальную особенность.
В табл. 4 среди прочих приведены примеры белков, которые называются сложными и представляют собой комплексы белка с молекулами непептидного типа (например, гемоглобин содержит железо, а казеин – фосфорную кислоту). Однако белки могут объединяться и с более сложными веществами, образуя гликопротеины, являющиеся обязательным компонентом клеточных поверхностей и внеклеточных опорных систем, или липопротеины, осуществляющие обмен липидами между печенью и другими органами.
Для олигопептидов (табл. 5) также не существует строгой структурно-функциональной классификации. К настоящему времени расшифровано более 4 тыс. разных аминокислотных последовательностей этих веществ, выделенных из животных, растений, грибов, бактерий и вирусов. Большинство из них по своим физиологическим функциям относят к регуляторным веществам, участвующим в регуляции всех основных регуляторных систем организма – нервной, эндокринной и иммунной. В соответствии с этим они и называются нейропептидами, олигопептидными гормонами и иммуномодуляторами. Кроме того, ряд олигопептидов рассматривается как медиаторы, прямо участвующие в синаптической передаче (нейропептиды), и модуляторы, осуществляющие регуляцию опосредованно (в том числе гормоны). Значительное число олигопептидов выполняет также защитные функции, представляя собой олигопептидные токсины.
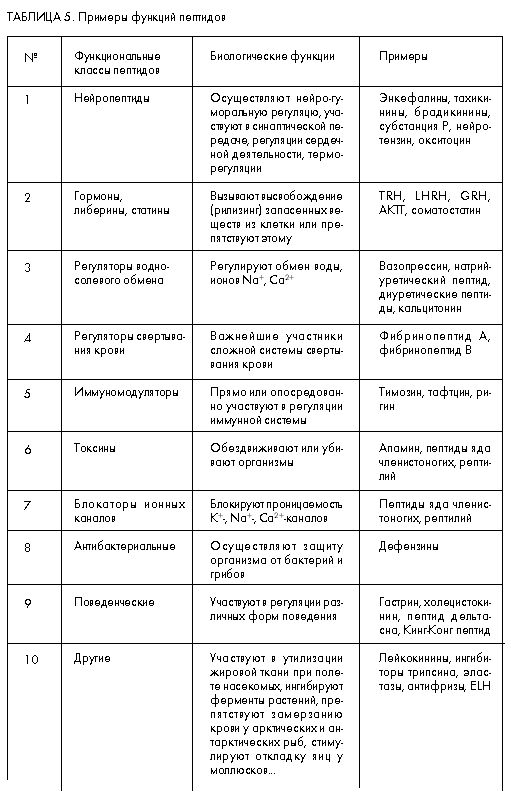
Нетрудно заметить, что часть функциональных свойств олигопептидов перекрывается с функциями белков (например, гормональные). Однако, как было уже отмечено выше, в силу разной подвижности целой молекулы и ее частей (конформационной подвижности) механизмы действия олигопептидных и белковых молекул разные.
Известны также примеры совершенно удивительных явлений и процессов, осуществляемых с участием природных олигопептидов. Приведем лишь некоторые из них.
Все знают об антибиотиках как об особом классе специфических веществ, способных подавлять деятельность микроорганизмов (или грибов) и использующихся в качестве лекарственных средств. Раньше эти вещества рассматривались как чужеродные человеку и большинству животных. Однако за последние два десятилетия выяснилось, что у млекопитающих (в том числе и в нейтрофилах крови человека), в коже амфибий (например, лягушек) в гемолимфе многих насекомых, в яде ряда рептилий (например, змей) образуются собственные антибиотики олигопептидной природы, обладающие антибактериальной активностью. Таким образом, эти вещества могут рассматриваться как еще один компонент иммунной регуляции.
Также всем хорошо известен функциональный класс наркотических веществ. Среди них – опий, представляющий собой высохший млечный сок из надрезов на незрелых коробочках опийного мака. В нем содержится около 20 различных алкалоидов, из которых морфин является основным в наркотическом действии на человеческий организм. А в 1975 г. группой английских ученых было обнаружено, что в мозге быка (и человека) присутствуют свои собственные вещества (энкефалины), обладающие морфиноподобным действием. Более того, природные фрагменты белков молока и мяса (казеина и гемоглобина) также обладают этим свойством, в результате чего они получили названия казоморфинов и геморфинов. Интересно, какова их физиологическая роль? Всем известно, что грудные младенцы, питающиеся в основном молоком матери, большую часть своей начальной жизни проводят во сне. Не эти ли вещества являются причиной такого поведения?
Коснувшись проблемы сна, нельзя не отметить и обнаружение олигопептида с весьма сложным названием – пептид, вызывающий дельта-сон. В этом названии, собственно, и описана функция, которая ему приписывается.
Какая только регуляция не осуществляется с участием природных олигопептидов! Например, в 1981 г. немецкие ученые Г.Шаллер и Г.Боденмюллер обнаружили, что у кишечнополостных (гидры и медузы) образуется специальный олигопептид, состоящий из 11 аминокислотных остатков и участвующий в морфогенезе. Потребовалось 10 лет для культивирования гидр, чтобы получить 3 кг необходимого материала для экстракции и выделить всего 0,5 мкг чистого олигопептида для определения аминокислотной последовательности. Однако эти гигантские усилия были вознаграждены. Впервые было показано, что полученный олигопептид способен вызывать стимуляцию роста головы животного. Но самое удивительное то, что через 3 года этими же учеными точно такой же олигопептид был обнаружен и в крови человека!
По-видимому, олигопептиды участвуют чуть ли не во всех физиологических процессах. В пищеварительной системе многих организмов сосуществуют олигопептиды противоположного действия – вызывающие чувство голода (гастрины) и сытости (холецистокинины). У насекомых при полете используются олигопептиды, участвующие в утилизации жировой ткани для выделения энергии, затрачиваемой на движение крыльев.
Многие животные продуцируют олигопептидные феромоны, привлекающие особей противоположного пола. Наконец, многие олигопептиды участвуют во вкусовом восприятии. Одни из них на вкус горькие, а другие – сладкие. Есть и такие, сладость которых в тысячи раз больше, чем у обычного сахара. А один из олигопептидов, выделенный из жареной говядины, получил название деликатесного за свой вкус.
Перечисление функциональных (биологических) свойств природных олигопептидов можно было бы продолжать довольно долго. Но в общем уже должно быть понятно, что олигопептиды в биологии существуют везде и их физиологическое действие практически безгранично.
Здоровье
Очевидно, что набор белков и олигопептидов у здорового организма должен быть вполне определенным. Отклонения от нормы могут приводить к заболеваниям, порою тяжким.
Одним из таких заболеваний является серповидноклеточная анемия, распространенная в ряде областей Африки, Индии, в некоторых средиземноморских странах и среди негритянского населения Северной Америки. У больных этой болезнью периодически (чаще под влиянием физической нагрузки) возникают приступы резкой слабости, тошноты и одышки. Внешняя причина – в необычно большом количестве незрелых эритроцитов и эритроцитов, имеющих форму тонкого серпа, что послужило основанием для такого названия этой болезни. Однако есть и более глубокое объяснение. Оказалось, что нормальные эритроциты содержат нормальный гемоглобин А, а серповидноклеточные – аномальный гемоглобин S. Выяснилось, что эти два белка отличаются всего одним аминокислотным остатком – в результате мутации в аномальном гемоглобине вместо остатка глутаминовой кислоты (E, табл. 1) на положенном месте стоит остаток валина (V). Замена лишь одного остатка и приводит к этому тяжкому заболеванию.
Обратившись к табл. 1, можно увидеть, что эти остатки несут принципиально разные боковые радикалы, и в мутантном гемоглобине осуществляется замена заряженного (отрицательно) радикала на гидрофобный.
В результате такой гемоглобин складывается в другую пространственную конфигурацию, и происходят последующие изменения как на клеточном уровне, так и на уровне целого организма.
Другой пример относится к онкологии. У человека, заболевшего одним из видов легочной карциномы, обнаруживают олигопептиды, которых у здорового организма нет. Эти олигопептиды – бомбезин и физалаэмин – в норме встречаются у европейской (Bombina bombina) и южноамериканской (Physalaemus fuseumaculatus) лягушек. В данном случае мутаций не было. В процессе начавшегося канцерогенеза у человека стали экспрессироваться (попросту говоря, работать) ранее «молчавшие» гены, в результате чего и образовались олигопептиды, информация о которых хранилась и в здоровом организме.
К проблеме здоровья относится также и то, насколько свежую (неиспорченную) пищу мы потребляем. При хранении открытых продуктов питания на воздухе в них поселяются различные патогенные микроорганизмы, и при достижении некоторого уровня их содержания пища может стать опасной для здоровья. Так почему же не добавлять к этим продуктам природные (человеческие) антибактериальные олигопептиды? Это безопасно для человека и позволяет дольше сохранять пищу при том, что сами эти вещества будут хотя и небольшим, но также пищевым компонентом.
Пошатнувшееся здоровье чаще всего лечат с помощью лекарств. Среди них – множество веществ абиогенного происхождения. Однако в ряде случаев наиболее эффективными являются такие, которые содержат природные белки или олигопептиды. Давно всем известны различные сыворотки, содержащие белки. А с недавнего времени стали применятьс