Курсовая работа: Экстремальные состояния вещества
Таким образом, плазменная частота - это резонансная или характеристическая частота системы образующих плазму заряженных частиц, зависящих от их массы. Время отдельного микроскопического взаимодействия не может превысить период плазменных колебаний, т.е. wp представляет собой нижний предел частоты микроскопического взаимодействия заряженных частиц.
Степень ионизации газа в зависимости от условий его существования может изменяться в широких пределах. Столб тлеющего разряда (например, в газоразрядных лампах) - это слабоионизированный газ со степенью ионизации порядка 10-8 -10-6 . Положительный столб дугового разряда при высоких (порядка атмосферного) давлениях газа имеет степень ионизации порядка 10-3 -10-1 .
Помимо степени ионизации ионизированный газ характеризуется концентрацией электронов, которая в зависимости от характера ионизационных процессов и плотности газа также изменяется в очень широких пределах. Так, концентрация электронов в канале молнии может достигать 10-102 1 /м3 , в то время как в ионосфере 1011 1/м3 .
2.2. Сравнительный анализ различных состояний вещества
Пути, по которым можно подойти к рассмотрению нижней границы области экстремальных состояний, удобнее всего определить по хорошо знакомой из школьных курсов физики и химии диаграмме фаз (см. рис. 3).
От тройной точки, в которой существуют твердая, жидкая и газообразная фазы вещества, на три стороны расходятся три линии. Одна из них, разграничивающая твердую и газообразную фазы, уходит к абсолютному нулю. Другая, отделяющая твердую фазу от жидкой, взмывает вверх. Можно двинуться к высоким давлениям вдоль нее, но мы выберем третью линию - границу "жидкость - газ".

Рис. 3. Фазовая диаграмма для области относительно малых давлений и температур. При условиях, соответствующих точкам пограничных линий, фазы находятся в равновесии; при условиях, соответствующих тройной точке, система состоит из твердой, жидкой и газообразной фазы одновременно. В критической точке жидкость и пар становятся тождественными по своим физическим свойствам; за этой точкой эти две фазы неразличимы.
Рассмотрим границу «жидкость-газ». Она обрывается в критической точке, где теряется различие между жидкостью и газом. С дальнейшим ростом температуры пропадает нужда и в самих этих терминах: вещество переходит в свое четвертое состояние - плазму.
Это слово и ляжет первым обозначением на ту часть области экстремальных состояний, которая принадлежит к вертикальному участку ее нижней границы.
Однако, нелогично было бы предполагать, чтобы свойства плазмы были совершенно одинаковыми на обоих концах столь протяженной полосы.
Вспомним, чем отличаются друг от друга более привычные для нас состояния веществ - твердое, жидкое и газообразное (см. рис. 4).
Твердое тело - это идеальный порядок. Выяснив расположение нескольких атомов в каком-либо участке кристалла, можно предсказать местоположение сколь угодно далеких их соседей по кристаллической решетке. Ошибка в определении координат каждого атома не превысит амплитуды его хаотических колебаний близ положения равновесия, обусловленных температурой.
Газ - это "идеальный" беспорядок. Каждый атом газа движется совершенно независимо от прочих, временами сталкиваясь с ними.
Жидкость - это нечто среднее между порядком и беспорядком. В кругу своих близких соседей каждый атом занимает определенное положение и колеблется около него, как в кристалле. Но такой порядок физики не зря называют ближним: дальние соседи движутся друг относительно друга совершенно хаотически, как атомы газа, - время от времени каждый атом меняет своих соседей.
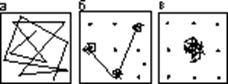
Рис. 4. Схематическое изображение траекторий движения частиц в газе (а), жидкости (б) и кристалле (в), при условии, что положения частиц во всех фазах фиксируются через равные промежутки времени. На двух последних рисунках точками обозначены атомы-соседи.
На ЭВМ удалось рассчитать движение частиц в плазме при больших давлениях. Оказалось, что частицы ведут себя совсем как жидкости: то и дело скачками меняя свое положение в пространстве и на некоторое время оставаясь верными тому ближнему порядку, который связывает их с соседями.
Плазму, для которой характерно такое поведение частиц, называют жидкоподобной. Как уже говорилось, плазма становится такой при больших давлениях. Близ оси температур она похожа по свойствам на идеальный газ и называется идеальной. (Границы, позволяющие различать агрегатные состояния вещества на рисунке обозначены белыми линиями, разделяющими цветные поля.)
Зона, где применим термин "жидкоподобная плазма", на диаграмме прилегает к тому месту, где нижняя граница области экстремальных состояний поворачивает к оси давлений. Теперь слегка изменим направление анализа: не прекращая наращивать давление, несколько снизим температуру.
С падением температуры уменьшится скорость хаотического движения частиц, рост давления заставит оголенные ядра теснее сблизиться друг с другом. Роль кулоновского взаимодействия между положительно заряженными ядрами возрастет. По этой причине ядрам будет энергетически выгодно выстроиться в определенном порядке, образовать кристаллическую решетку.
Итак, мы пришли к линии раздела твердой и жидкой фаз. Рассмотрим теперь понятие и явление плавления.
Известно, что в привычных земных условиях плавление обычно вызывается повышением температуры. С ее ростом увеличивается амплитуда шатаний атомов близ узловых точек кристаллической решетки; она становится сравнимой с расстоянием между узлами, а когда составит от этого расстояния примерно четверть (к такой цифре приводит теоретическая оценка; в нормальных комнатных условиях оценку подтверждают эксперименты с нормальными металлами), начнется переход в жидкую фазу.
Можно провести то же рассуждение в обратном порядке: чем ниже температура, тем меньше амплитуда хаотических колебаний атомов, тем точнее определяется их положение в узлах решетки.
Однако обратный ход нашего рассуждения сдерживается закономерностями квантовой механики. В последней фразе предыдущего абзаца можно усмотреть покушение на один из основных ее принципов - принцип неопределенности. Согласно законам квантовой механики, нельзя определить одновременно со сколь угодно высокой точностью и положение и скорость частицы, и, следовательно, нельзя говорить о том, что частица замирает с нулевой (точно определенной!) скоростью в каком-либо (строго определенном!) положении равновесия. Так что даже при температуре, стремящейся к абсолютному нулю, атомы кристалла будут совершать колебания близ положений равновесия - нулевые колебания, как принято их называть в отличие от тепловых.
В соответствии с тем же принципом неопределенности амплитуда нулевых колебаний становится тем больше, чем сильнее стеснены движения атома, чем строже задано положение равновесия. Давление как раз и служит таким стесняющим обстоятельством. Растет давление - растет и амплитуда нулевых колебаний. И вот она становится сравнимой со все уменьшающимся расстоянием между узлами кристаллической решетки. При температуре, близкой к абсолютному нулю, наступает момент холодного плавления твердого тела.
Таким образом, существуют предельные значения температуры, плотности и давления, выше которых кристаллическое состояние невозможно, и, чтобы убедиться в этом, можно было и не отправляться в область экстремальных состояний: именно квантовым эффектом холодного плавления объясняется существование жидкого гелия при низких температурах и атмосферном давлении.
Впрочем, многие вопросы, связанные с холодным плавлением, до сих пор остаются открытыми.
Любопытным вопросом являются процессы, которым подвергаются электроны в области экстремальных состояний (до сих пор, применительно к атомам, речь шла в основном о ядрах). За нижней ее границей электроны отрываются от ядер, пополняя собой самостоятельную электронную компоненту вещества.