Курсовая работа: Электроосаждение металлов
2. В электрохимических процессах легко изменяется потенциал изменением тока, протекающего через электрод, достигая таких значений окислительно-восстановительного потенциала, которые создают уникальные возможности для процессов окисления и восстановления.
3. С использованием диафрагм или ионообменных мембран в электролизерах оказывается возможным одновременно получать несколько чистых продуктов (например, при электролизе раствора NaCl получают Cl2, H2 и щелочь).
Недостатки.
1. Большой расход электроэнергии, которая затрачивается на электрохимические превращения.
2.Относительно невысокая производительность электрохимических процессов (гетерогенных процессов, протекающих на границе электрод-раствор). В результате имеют место относительно высокие капитальные затраты на оборудование, здания. В настоящее время нашли широкое применение пористые электроды, позволяющие значительно увеличить удельные поверхности, на которых осуществляются электрохимические реакции. Это позволяет повысить производительность электрохимических устройств за счет повышения плотности тока, в общем случае, путем повышения «амперной нагрузки» на единицу производственной площади. При общей оценке вклада в экономику ЭХТ следует отметить, что только стоимость хлора и щелочи, производимых электролизом, составляет около 10 % общей стоимости продукции химической промышленности. Общая мощность ХИТов , находящихся одновременно в эксплуатации, превышает мощность всех электростанций мира. С экологической точки зрения электрохимические производства характеризуются весьма токсичными продуктами (Cl2 и F2 ) и использованием в производстве сильно токсичных веществ: ртуть в качестве электрода, асбест в качестве диафрагменного материала и т.д. Поэтому вопросы охраны труда и техника безопасности очень важны! Электрохимический объект - это основной элемент электрохимической технологии. Объект может принадлежать к классу искусственных или естественных электрохимических объектов. Могут быть объекты, являющиеся промежуточными. Искусственные объекты – это электрохимические устройства, естественные – коррозионные процессы. К промежуточным можно отнести безэлектролизные объекты (функционирующие без внешнего тока), в которых проходящие на поверхности технических объектов самопроизвольные окислительно-восстановительные процессы. Сюда относят процессы химической металлизации, травления, оксидирования, фосфатирования, хроматирования,
пассивирования, активирования металлов и другие подобные технологические приемы. Они протекают самопроизвольно без внешнего тока, но условия оптимального протекания создаются искусственно.
В некоторых случаях герметичность ЭХУ нужна для того, чтобы электролиты не взаимодействовали с внешней средой. С помощью штуцеров 13 и 14 устройство может включаться в гидравлическую схему (постоянно или временно)
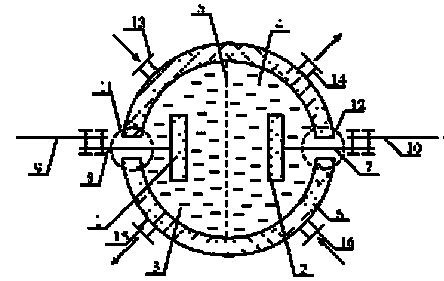 |
Рис. 1.1- Обобщенная схема электрохимического устройства-1, 2 – электроды (анод, катод); 3, 4 – электролиты, находящиеся в анодном и катодном пространствах (анод – анолит, катод - католит); 5 – разделитель (сепаратор, диафрагма, мембрана), предназначен для формирования анодного и катодного пространств; 6 – корпус; 7, 8 –токоотводы от электродов (электронные проводники); 9, 10 –токоотводы от внешней цепи (элементы внешней электрической цепи); 11, 12 – узлы герметичного вывода токоотводов из корпуса электрохимического устройства.
Электроды ЭХУ могут быть твердыми, но могут быть и жидкими, например, таким является расплавленный катод в электролизере для получения алюминия или ртутный катод в хлорном электролизере. По геометрической характеристике они могут быть гладкими или пористыми. Поверхности электродов могут быть покрыты каталитическими слоями, природа которых может быть разнообразна, и определяется спецификой реакций на электроде.
Электроды могут быть газовыделяющими или газопоглощающими (газодиффузионными). Пористая структура электродов обеспечивает увеличение реакционной поверхности и увеличение интенсивности процесса в электрохимических устройствах. Важное место в электрохимических технологиях принадлежит электродам, при формировании которых используются явления гидридообразования и интеркаляции, а также электродам с полупроводниковыми, алмазными, каталитическими (в том числе, биокаталитическими) слоями.
Является в форме электрической энергии, а во втором — в форме теплоты. Для этого возьмем какое-либо химическое превращение, например Cu2 +
Если эта реакция протекает как химический процесс, то она будет характеризоваться рядом особенностей.
Реакция возможна только при столкновении ее участников друг с другом. Следовательно, необходимость контакта реагирующих частиц является первой характерной особенностью химического процесса.
В момент столкновения, когда реагирующие частицы вплотную подходят друг к другу, становится возможным переход электронов от одной частицы к другой. Совершится ли такой переход в действительности, зависит от энергии реагирующих частиц и ее соотношения с энергией активации; энергия активации является функцией природы химической реакции и для ионных реакций она обычно невелика. Путь электрона при таком переходе очень мал, что является второй характерной особенностью химического процесса.
Столкновения могут происходить в любых точках реакционного объема и при любых взаимных положениях реагирующих частиц в пространстве, поэтому электронные переходы могут совершаться в любых направлениях в пространстве (рис. 1). Хаотичность, беспорядочность столкновений между реагирующими частицами и пе-направленность электронных переходов являются третьей характерной особенностью химического процесса.
В результате этих особенностей энергетические эффекты химических процессов проявляются в форме теплоты. Чтобы энергетические изменения, соответствующие химическому превращению, проявлялись в виде электрической энергии, т. е. чтобы происходил электрохимический процесс, необходимо изменить условия его протекания.
Получение или затрата электрической энергии всегда связаны с прохождением электрического тока, представляющего собой поток электронов, перемещающихся по одному и тому же пути. Условия протекания химической реакции необходимо поэтому изменить так, чтобы электронные переходы были не беспорядочны, а совершались в одном определенном направлении. Использование энергии электрического тока возможно лишь в том случае, если путь электронов велик по сравнению с размерами атомов. Таким образом, в электрохимических процессах переход электронов от одного участника реакции к другому должен совершаться по достаточно длинному пути. Однако путь электрона не может быть большим, если реагирующие частицы контактируют друг с другом. Поэтому для электрохимического процесса обязательно пространственное разделение участников реакции. Но одного только пространственного разделения недостаточно, так как оно приведет к прекращению химической реакции, а не к превращению ее в электрохимическую. Для осуществления электрохимического процесса необходимы дополнительные условия: электроны должны отрываться от ионов меди и по одному общему пути переходить к ионам железа. Этого можно достичь, заменив непосредственный контакт между участниками реакции их контактом с двумя металлическими телами, соединенными между собой металлическим проводником. Для того чтобы поток электронов был непрерывным, необходимо обеспечить прохождение электрического тока также и через реакционное пространство. Оно обычно осуществляется и участниками электрохимической реакции (если они находятся в ионизированном состоянии), и специально добавленными соединениями, обладающими в данных условиях высокой ионной проводимостью.
При электрохимической реакции прямой контакт между реагирующими частицами заменяется их контактом с соответствующим металлом. При этом реакция и связанные с ней энергетические изменения остаются теми же (независимо от того, протекает она по химическому или же электрохимическому пути), но кинетические условия могут быть различными. Энергия активации при электрохимическом механизме благодаря каталитическим свойствам металлов может быть иной, чем при гомогенном химическом механизме, кроме того, она зависит от потенциала. В электрохимических реакциях обязательно участвуют электроны, а часто и другие заряженные частицы — катионы и анионы, что составляет одну из их основных характерных особенностей. Энергия таких частиц, естественно, является функцией электрического поля, создаваемого на границе электронопроводящее тело — электролит.
Отсюда следует, что и скорость электрохимической реакции зависит не только от температуры, активностей ее участников и катализатора, т. е. от тех же факторов, которые определяют скорость химической реакции, но и от потенциала на границе раздела фаз различной проводимости. Варьирование потенциала границы, при сохранении постоянными концентраций участников электрохимической реакции и температуры, позволяет в десятки, сотни и тысячи раз менять скорость реакции, а в ряде случаев и природу ее продуктов. Это делает электрохимические реакции более управляемыми, легче контролируемыми, чем химические. Электрохимические реакции можно определить как такие химические реакции, скорость которых является функцией потенциала . Поэтому электрохимические реакции отличаются от химических не только по энергетическому эффекту процесса, но также и по величине энергии активации.
Взаимное превращение химической и электрической форм энергии совершается только в электрохимических системах, поэтому их изучение составляет предмет электрохимии.
Электрохимическая система содержит следующие составные части (рис. 2).
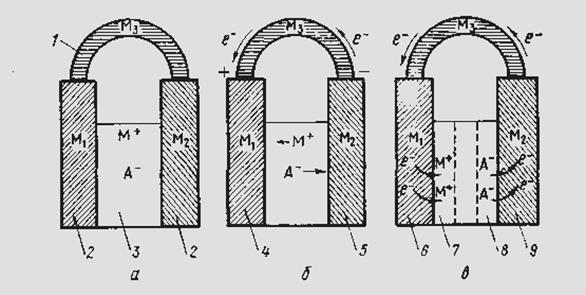 |
Рис. 2. Схематическое изображение электрохимической системы:
а — равновесная электрохимическая система; б —химический источник тока; в — электрохимическая ванна; / — внешняя цепь; 2 — электроды; 3 — электролит; 4 — положительный электрод; 5 — отрицательный электрод; 6 — катод; 7 — като-лит; 8 — анолит; 9 — анод
1.Реагенты, а также ионизированные или способствующие ионизации реагентов вещества, обеспечивающие прохождение электрического тока; эта часть системы является ионным проводником электричества (проводник II рода) и называется электролитом.
2.Два электронопроводящих тела, контактирующие с электролитом и обеспечивающие обмен зарядами с участниками электрохимической реакции, а также передачу электронов во внешнюю цепь (см. ниже) или получение их из внешней цепи; они называются электродами. На электродах — на границе раздела двух различно проводящих фаз — происходит перенос заряда, т. е. протекают электрохимические реакции, иными словами, именно здесь локализовано взаимное превращение химической и электрической форм энергии. Электроды поэтому следует рассматривать как наиболее важную часть электрохимической системы
3. Металлический проводник (проводник I рода), соединяющий электроды и обеспечивающий прохождение тока между ними; он называется внешней цепью.
Если электролит представляет собой токопроводящий раствор одного или нескольких веществ в воде или ином растворителе, то такие системы относятся к электрохимии водных или неводных растворов; если электролитом служит расплавленная соль (или смесь расплавленных солей и оксидов), эти системы относятся к электрохимии расплавов или расплавленных сред; если межэлектродное пространство заполнено газом — к электрохимии газов. Электрохимическая система может находиться в равновесном (рис. 2, а) или неравновесном (рис. 2, б, в) состоянии.
Электрохимическая система, производящая электрическую энергию за счет протекающих в ней химических превращений, называется химическим источником тока или гальваническим элементом (рис. 2, б). Здесь электрод, посылающий электроны во внешнюю цепь, называется отрицательным электродом или отрицательным полюсом элемента. Электрод, принимающий электроны из внешней цепи, называется положительным электродом или положительным полюсом элемента.
Электрохимическая система, в которой за счет внешней электрической энергии совершаются химические превращения, называется электролизером или электролитической ванной (рис. 2, в). Электрод, принимающий электроны от участников реакции, называется анодом. Электрод, отдающий электроны участникам реакции, — катодом. Часть электролита, примыкающая к аноду, называется анолитом; примыкающая к катоду — католитом.
Поскольку потеря электронов отвечает реакции окисления, а их приобретение — реакции восстановления, то можно сказать, что анод — это электрод, на котором происходит окисление, а катод — электрод, на котором происходит восстановление. Поэтому анод одновременно является отрицательным, а катод — положительным полюсом химического источника тока.