Курсовая работа: Энергетический обмен головного мозга
Установлено, что активности этих ферментов в головном мозге молодых животных в 1,5–2 раза выше, чем у взрослых. Максимальные значения активностей отмечаются исследователями в период наиболее интенсивной миелинизации; у крыс этот период соответствует 20–30 дням постнатального развития. Более высокая активность найдена в головном мозге растущих животных и для ферментов неокислительной части пентозофосфатного пути: трансальдолазы, тракскетолазы, фосфопентоизомеразы и др. Все эти данные свидетельствуют о том, что такой путь метаболизма глюкозо-6-фосфата играет в развивающейся нервной ткани большую роль, чем в окончательно сформировавшемся мозге взрослых животных.
Определение скорости ПФП в экспериментах с глюкозой, содержащей С в положении «1» или «6», позволило рассчитать, что в мозге растущих животных в ПФП используется до 10–15% поступающей в мозг глюкозы, в то время как в мозге взрослых животных – лишь 2–3%.
В ходе окончательной дифференцировки и созревания структур головного мозга у новорожденных и молодых животных особенно интенсивно протекают процессы синтеза специфических липидов, в частности липидов миелиновых оболочек. Заканчивается деление и пролиферация различных типов нервных клеток. Такие морфологические изменения в ходе созревания мозга требуют повышенного образования восстановительных эквивалентов для реакций биосинтеза липидов, а также фосфопентоз как предшественников нуклеиновых кислот. Именно эти потребности покрываются за счет реакций ПФП. После окончания процессов миелинизации и пролиферации нервной ткани интенсивность этого пути метаболизма глюкозо-6-фосфата в головном мозге заметно снижается. Напротив, в ряде других тканей, где у взрослых животных идут интенсивные процессы липогенеза, относительная доля ПФП среди реакций метаболизма глюкозо-6-фосфата постепенно возрастает.
Сопоставление активности ферментов пентозофосфатного пути в различных типах клеток взрослого мозга позволило сделать вывод о разной его интенсивности в нейронах и нейроглии. Гистохимическими методами, а также при прямом определении в нейроглии в отличие от нейронов найдены более высокие значения активности глюкозо-6-фосфатдегидрогеназы, 6-фосфоглюконатдегидрогеназы, транскетолазы и других энзимов ПФП. Таким образом, в нейроглии пентозофосфатный путь является существенным путем метаболизма глюкозо-6-фосфата, в то время как в нейронах доминирует аэробный гликолиз, сопряженный с последующими реакциями цикла трикарбоновых кислот.
Фосфофруктокиназная реакция. Как уже упоминалось, основная масса глюкозо-6-фосфата в головном мозге используется в реакциях аэробного гликолиза. Важнейшим этапом гликолитической цепи, с точки зрения возможности контроля над скоростью гликолиза, является фосфофруктокиназная реакция. Активность фосфофруктокиназы в головном мозге и многих других тканях заметно ниже активности остальных ферментов гликолиза, в силу чего эта реакция может лимитировать общую скорость потока метаболитов по гликолитической цепи.
В отличие от гексокиназы запас каталитической мощности фосфофруктокиназы относительно невелик; увеличение активности этого фермента под действием кинетических регуляторных механизмов происходит в ограниченных пределах. Поэтому при ряде экстремальных воздействий скорость потока метаболитов по гликолитической цепи ограничивается именно на реакции фосфорилирования фруктозо-6-фосфата.
Фосфофруктокиназа имеет тетрамерную субъединичную структуру и состоит из комбинаций протомеров: мышечной, печеночной и мозговой или тромбоцитарной форм.
В головном мозге, как и в других тканях, в регуляции скорости фосфорилирования фруктозо-6-фосфата принимают участие одновременно несколько механизмов, однако их относительная роль в том, или ином органе различна. Фосфофруктокиназа представляет собой поливалентный аллостерический фермент активность которого подавляется АТФ и цитратом и стимулируется АДФ. Действие этих основных регуляторных факторов дополняется другими. В частности, АМФ и неорганический фосфат снимают ингибирующее действие АТФ; аналогичным образом влияет продукт реакции – фруктозодифосфат.
Изоферменты фосфофруктокиназы отличаются по чувствительности к регуляторным факторам: B-форма наиболее, а М-форма наименее чувствительна к ингибированию АТФ; В-форма сильно активируется фруктозодифосфатном, в то время как М-форма почти не активируется. Определенную роль в регуляции активности фермента в мозге играет кальмодулинзависимое фосфор илирование; в последние годы установлено участие в этом процессе нейроспецифического белка S-100.
Таким образом, рост отношения АТФ/АДФ как аллостерических эффекторов и компонентов цикла фосфорилирования – дефосфорилирования фермента приводит к снижению фосфофруктокиназной активности, а уменьшение отношения АТФ/ АДФ, напротив, повышает скорость реакции. По-видимому, этот механизм регуляции является ведущим в системе множественного контроля над активностью фосфофруктокиназы в головном мозге.
Необходимо подчеркнуть, что отношение АТФ/АДФ одновременно с фосфофруктокиназой контролирует и активность гексокиназы, причем направленность изменений – стимуляция или ингибирование – одинакова для обеих киназ. Это дало основание У. Лоури и соавторам рассматривать гексокиназу и фосфофруктокиназу в мозге как единый функциональный комплекс.
Двойной контроль над активностью важнейших энзимов гликолиза со стороны компонентов энергетического обмена является характерной особенностью головного мозга. Наличие синхронной регуляции одним и тем же фактором активности двух ведущих ферментов гликолитической цепи позволяет быстро и эффективно изменять скорость окисления глюкозы в клетках головного мозга в зависимости от изменений энергетического баланса.
Еще один механизм контроля над активностью фосфофруктокиназы, а именно – ингибирование фермента цитратом, в головном мозге играет, по всей вероятности, значительно меньшую роль, чем в других тканях. Это может быть обусловлено особенностями метаболизма лимонной кислоты в мозге.
Как известно, основным источником цитрата в мозге служит ацетилКоА, образующийся при окислительном декарбоксилировании пирувата. В то же время в других тканях значительные количества ацетилКоА для синтеза цитрата образуются при окислении жирных кислот, т.е. имеет место конкуренция между гликолизом и липолизом. Кроме того, в головном мозге взрослых животных лимонная кислота быстро окисляется в том же компартменте, где синтезируется, – в митохондриях, в силу чего концентрация этого метаболита в цитоплазме обычно не достигает значений, близких к К фосфофруктокиназы.
Конечные этапы гликолиза в головном мозге. Реакции, следующие за образованием фрустозо – 1,6 – дифосфата, в головном мозге катализируются ферментами, активность которых достаточно высока и в 5–10 раз превышает активность гексокиназы и фосфофруктокиназы. Поэтому ни скорость расщеплення фруктозо– 1,6–дифосфата, ни последующие этапы превращения фосфотриоз обычно не лимитируют общую скорость аэробного гликолиза в мозговой ткани.
Рассматривая ферментативные превращения фосфотриоз, необходимо отметить характерную для нервной ткани локализацию изоферментов енолазы. В глиальных клетках обнаружен гомодимер аос, идентичный енолазе печени, в то время как изоформа встречается только в нейронах. Установлена идентичность нейрональной формы енолазы и нейроспецифического кислого белка 14–3–2, описанного Б. Муром.
Как уже указывалось, в отличие от многих органов с интенсивным липолизом или интенсивно протекающим пентозофосфатным циклом в мозге взрослых животных дополнительный поток в пул метаболитов гликолиза трехуглеродных фрагментов имеет весьма ограниченное значение. Результаты экспериментов с различными предшественниками показывают, что на долю промежуточных компонентов гликолиза, образовавшихся из С-глицерата, в мозге приходится не более 2–5%. Это еще раз показывает важность для метаболизма головного мозга гексокиназной реакции, которая служит основным путем ввода углеродных компонентов в гликолитическую цепь.
Конечным продуктом аэробного гликолиза является пировиноградная кислота, основные пути метаболизма которой приведены на схеме 3. Рассматривая их, необходимо учитывать, что цитоплазматический пируват с помощью протонзависимой переносящей системы легко проникает через митохондриальные мембраны и включается в метаболические превращения в обоих клеточных компартментах.
Что касается реакций образования пирувата из аминокислот серина, глицина, треонина, цистина и цистеина, протекающих в цитоплазме, то они наиболее интенсивно осуществляются в печени и почках. В головном мозге они играют весьма малую роль в пополнении пула пирувата из-за низкой активности ферментов и очень плохой проницаемости ГЭБ для этих аминокислот.
Три реакции связывают пируват с ЦТК: пируеатдегидрогеназная, пируваткарбоксилазная и НАДФ-малатдегидрогеназная; если две первые протекают исключительно в митохондриях, то реакция, катализируемая НАДФ-малатдегидрогеназой, так называемым «маликэнзимом», протекает как в митохондриях, так и в цитоплазме. Основным путем включения углеродного скелета пировиноградной кислоты в ЦТК в мозге служит пируватдегидрогеназная реакция, тогда как в других тканях – печени, сердечной и скелетных мышцах, почках и др. – большее значение имеют реакции карбоксилирования пирувата, в первую очередь пируваткарбоксилазная реакция.
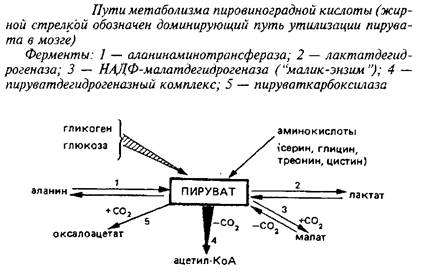
Легко обратимая аланинаминотрансферазная реакция протекает в митохондриальном и цитоплазматическом компартментах; в связи с тем, что активность соответствующего фермента невелика, эта реакция играет относительно небольшую роль в метаболизме пирувата в мозге. Эксперименты с С-предшественниками позволили рассчитать, что лишь около 2% пирувата превращается в аланин в физиологических условиях.
Однако участие в трансаминировании двух важнейших метаболитов нервной ткани – глутамата и а-кетоглутарата – заставило исследователей более внимательно изучить этот минорный путь метаболизма пирувата. Высказано предположение, что иитоплазматическая АлАТ может участвовать в регуляции конечных этапов гликолиза и утилизации глутамата.
Среди конечных этапов гликолиза и реакций, в которых участвует пировиноградная кислота, определенный интерес представляет лакташдегидрогеназная реакция. Подавляющая доля лактатдегидрогеназы в большинстве тканей связана с цитоплазмой. Однако в головном мозге до 10% от общей лактатдегидрогеназной активности клеток обнаруживается в митохондриях. В других тканях митохондриальной лактатдегидрогеназы значительно меньше; в печени, например, менее 1%. Предполагается, что это способствует более полному использованию конечных продуктов гликолиза в митохондриях.
ЛДГ и ее изозимы неравномерно распределяются между основными типами клеток мозга. Общая активность ЛДГ при расчете на 1 мг белка в глиальных клетках выше, чем в нейронах. На обогащенных фракциях и на культурах клеток показано преобладание «анаэробного» изофермента ДДГ5 в глиальных клетках, в то время как для нейронов характерен «аэробный» изофермент ЯДГу Эти наблюдения, а также данные о меньшей скорости поглощения кислорода глиальными клетками по сравнению с нейронами хорошо согласуются со сделанным Х. Хид