Курсовая работа: Генетически модифицированные организмы в колбасных изделиях
Основная масса исследований, которые привели к развитию генной инженерии, проводилась на классическом объекте микробиологов – кишечной палочке Escherichia coli. С помощью специальных ферментов – эндонуклеаз рестрикции, или рестриктаз, плазмида, несущая какой-нибудь маркерный ген, например, ген устойчивости к определенному антибиотику, разрезается в строго определенном месте с образованием с каждой стороны нескольких (от одного до пяти) неспаренных оснований – «липких концов». С помощью таких же рестриктаз получается фрагмент генома организма-донора, несущий нужный ген, например, ген человеческого инсулина. В последнее время донорную ДНК чаще получают путем «пришивания» «липких концов» к молекуле ДНК, полученной путем обратной транскрипции с матричной РНК нужного гена (кДНК). Главную роль здесь играет фермент обратная транскриптаза, или ревертаза, впервые открытая у ретровирусов (таких как ВИЧ и некоторые возбудители злокачественных новообразований – онковирусов). Далее за счет комплиментарного взаимодействия неспаренных оснований «липких концов» происходит включение нужного гена в плазмиду, при этом образуется новая рекомбинантная (гибридная) ДНК. Завершает процесс фермент ДНК-лигаза, которая ковалентно зашивает разрывы в цепях ДНК.
Следующий этап – перенос рекомбинантной плазмиды в бактерию.
Такой процесс – включение чужеродной ДНК в бактериальную клетку носит название трансформации, а молекула ДНК – вектор. Это явление иногда встречается в природе, что говорит о том, что трансформация – это естественный биологический процесс. В естественных условиях трансформация встречается у таких бактерий, как возбудитель пневмонии.
Другой способ построения векторных молекул использует бактериофаги – особую группу вирусов, заражающих исключительно бактерии. Наиболее широкое применение получил бактериофаг. Средняя часть генома этого вируса не несет в себе важных функций и может быть заменена на чужеродный фрагмент ДНК. В настоящее время существует очень много векторов, сконструированных на основе различных плазмид и бактериофагов.
Значительно сложнее подвергнуть генетической модификации эукариотические микроорганизмы, к которым относятся грибы, протисты, растения и животные. Как и у бактерий, у них имеются плазмиды, но использование их в качестве векторов часто оказывается не очень эффективно. Поэтому для того, чтобы возник стабильный трансформант, необходимы два последовательных события: проникновение рекомбинантной ДНК в клетку и ее интеграция в хромосомную ДНК. Такой метод называется интегративной трансформацией. В дальнейшем генно-инженерное конструирование у дрожжей пошло по пути создания кольцевых плазмид с центромерами, особыми участками ДНК, обеспечивающими связь с белками веретена деления и, следовательно, равномерное распределение таких плазмид между двумя клетками во время митоза. Развитие этого подхода привело к созданию целых искусственных мини-хромосом, содержащих, помимо центромерного участка, теломеры на концах, загнутые в виде шпильки, и репликаторы – участки начала репликации ДНК. Подобные минихромосомы могут включать сразу несколько полезных генов, что обеспечивает производство нужной биотехнологической продукции.
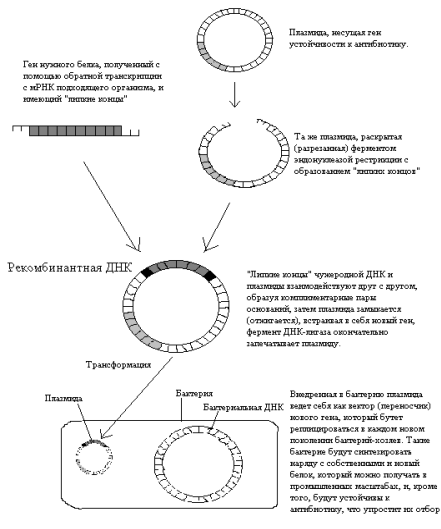
Рис. 1. Упрощенная схема получения
генетически модифицированного микроорганизма
Получение трансгенных растений
Вся работа с трансгенными растениями направлена на коренное изменение методов традиционной селекции – желаемые признаки получаются благодаря введению нужных генов непосредственно в растение вместо длительной работы по скрещиванию различных линий. Сложность такого подхода заключена в том, что в отличие от бактерий и дрожжей, растения, как и животные, являются многоклеточными организмами. Для получения продукта нужный ген должен находиться в каждой клетке организма, что достаточно сложно осуществить. В этом плане растения имеют одно важное преимущество перед животными: возможна их полная регенерация in vitro из недифференцированных соматических тканей с получением нормальных, способных давать семена, растений. Это свойство, называемое тотипотентностью, дает уникальную возможность получить из единичных клеток, генотип которых можно изменить аналогично микроорганизмам, целое растение с новыми признаками. Задача осталась за поиском подходящего вектора для переноса нужного гена в выделенные камбиальные клетки.
Исследователям помогла сама природа. Еще древним грекам было известно явление, называемое корончатыми галлами. В пораженных растениях клетки корончатых галлов приобретают способность неограниченно размножаться, оставаясь недифференцированными. Такие клетки по своим свойствам очень похожи на раковые клетки животных. Но только в XX веке ученым удалось установить и изучить причину возникновения такого явления. Виновницей оказалась одна из почвенных бактерий –Agrobacterium tumefaciens. Такая бактерия, как и многие другие, содержит плазмиды. Одна из них, названная Ti-плазмида (от английского сокращения «опухоль индуцирующая»), и оказалась опухолеродным агентом для клеток зараженного растения.
Ti-плазмида состоит из нескольких функционально различных участков ДНК. Наиболее важную роль играет участок Т-ДНК, который переносится в клетку зараженного растения и встраивается в ее хромосому. Там находятся гены синтеза фитогормонов и опинов. Фитогормоны ауксин и цитикинин подавляют дифференцировку опухолевых растительных клеток и переводят их в состояние деления, а опины используются бактерией как источник углерода, азота и энергии. Другими участками ДНК в Ti-плазмиде являются tra-область, где локализованы гены, контролирующие коньюгацию бактерий, и ori-область, продукты которой обеспечивают размножение плазмиды в бактериальной клетке. Еще один важный локус ДНК называется vir-область. Там содержатся гены, ответственные за перенос Т-ДНК в растительную клетку и встраивание ее в хромосому.
При заражении какого-нибудь двудольного растения Агробактерией происходят следующие процессы: Агробактерии, в изобилии находящиеся в почве, вступают в контакт со стеблем растения, чаще всего в прикорневой области. Вероятность заражения и опухолевой трансформации значительно возрастает, если у растения имеются ранки или повреждения наружного слоя клеток. Бактерии прорастают в ткани растения, живут и размножаются в межклеточном пространстве, не проникая в клетки. Далее происходит процесс трансформации, который можно разделить на несколько этапов: прикрепление бактерии к стенке растительной клетки, проникновение Т-ДНК внутрь клетки, интеграция Т-ДНК в геном растения и экспрессия плазмидных генов. Переноса Т-ДНК не происходит, если растение-хозяин оказывается больным или нежизнеспособным. Если же хозяин окажется здоровым организмом, перенос Т-ДНК происходит примерно за 30 минут. После встраивания в хромосому Т-ДНК становится частью генома растения, и ее гены активно транскрибируются. Клетка приобретает свойства раковой, и происходит рост опухоли – корончатого галла. Бактерии используют трансформированные клетки как фабрику по производству опинов – источника азота, углерода и энергии.
Таким образом, Агробактерии научились генно-инженерным методам задолго до человека. Ti-плазмида оказалась идеальным природным вектором для введения чужеродных генов в клетки растения. Необходимо также отметить следующие достоинства использования методов на основе применения Ti-плазмиды. Во-первых, круг растений – хозяев Агробактерии чрезвычайно широк, включая практически все двудольные растения. В последнее время ученые смогли добиться заражения и многих однодольных, главным образом злаков. Во-вторых, встроенная в геном растения Т-ДНК наследуется как простой доминантный признак по законам Менделя, а чужеродные гены имеют собственные регуляторные области. Для промышленного применения Ti-плазмиду необходимо лишь «немного» усовершенствовать. В целом векторная система на основе Ti-плазмиды должна содержать следующие участки:
1) комплекс генов vir-области, необходимой для переноса и интеграции рекомбинантной ДНК в хромосому растения;
2) систему для узнавания чужеродных генов полимеразами растения –
такой промотор есть в Т-ДНК;
3) маркер, необходимый для селекции трансформированных клеток;
4) уникальные сайты рестрикции, необходимые для введения в конструкцию нужных генов.
Также необходимым условием является отсутствие генов, приводящих к образованию опухоли.
Чаще всего для создания такой генно-инженерной конструкции используют следующий подход. Сегмент Т-ДНК вырезают из Ti-плазмиды с помощью рестриктаз и встраивают в стандартную плазмиду-вектор бактерии Escherichia coli. Рекомбинантная плазмида размножается, и в участок Т-ДНК вставляют нужный ген так же, как и в обычную плазмиду, с использованием рестриктаз. Такой молекулярный гибрид вводят в Agrobacterium tumefaciens, содержащий неизмененную Ti-плазмиду. Благодаря процессу рекомбинации происходит обмен гомологичными участками ДНК рекомбинантной и Ti-плазмид. В результате получится рекомбинантная Ti-плазмида, несущая нужный ген. Последним этапом будет заражение единичных растительных клеток такой Агробактерией и выращивание целого растения, все клетки которого будут экспрессировать нужный ген.
Иногда оказывается проще использовать сразу две рекомбинантные плазмиды. Одна из них содержит только vir-область и является плазмидой-помощницей. Вторая плазмида должна содержать Т-ДНК со встроенным нужным геном. Плазмида-помощница способна переносить в растительную хромосому не только свою Т-ДНК, которой у нее и нет, но и соседнюю. Для облегчения отбора полученных ГМ-растений, рекомбинантная Ti-плазмида несет специальный маркерный ген. В отличие от микроорганизмов, где в качестве маркера используется устойчивость к антибиотикам, в растениях используют особые белки, обладающие способностью светиться в ультрафиолетовом свете. Наиболее часто используют гены люциферазы светлячков и ген GFP медузы (по-английски, «зеленый светящийся белок»).
Помимо технологии, основанной на использовании Ti-плазмиды, в последнее время применяются и другие способы переноса рекомбинантной ДНК в растения. Современный арсенал методов трансформации очень обширен и включает такие подходы, как электропорация клеток (пропускание электрического разряда через смесь опытных клеток и рекомбинантных плазмид, при этом в мембранах клеток возникают бреши, и ДНК проникает в клетку и встраивается в геном), встряхивание смеси клеток, ДНК и микроигл (которые прокалывают мембраны аналогично электрическом току),опосредованная вирусами инфекция, микроинъекции ДНК в клетки. Промышленное применение нашла следующая технология: с помощью специального прибора «Shotgan» осуществляется обстрел растительных тканей мельчайшими пульками из золота или вольфрама, одетыми в молекулы ДНК.
В отдельных случаях оказывается необходимо не ввести какой-нибудь новый ген в растение, а наоборот, заблокировать или ослабить действие природного гена. В качестве примера могут служить плоды томата, которые во время созревания содержат значительное количество специального белка PG, придающего плодам рыхлость. Для устранения этого белка в плоды вводят вектор, содержащий перевернутую копию его гена. В результате транскрипции получается антисмысловая (перевернутая) мРНК, которая комплиментарно связывается с нормальной мРНК. Образуется молекула двухцепочечной РНК, которая уже не может служить матрицей для синтеза белка. В результате получаются томаты с новыми свойствами плодов, которые тверже, дольше хранятся и более устойчивы к грибковым заболеваниям.
Не менее перспективным является направление по генной инженерии не ядерного генома, а генома пластид и митохондрий. В трансгенном материале значительно увеличивается содержание продукта за счет более активных метаболических процессов. Еще множество различных подходов, включая регуляцию активности генов, находятся на стадии разработки.
Обнаружение ГМ-продуктов с помощью CIM-монолитных колонок для выделения ДНК
Для выявления ГМ–продуктов был предложен новый метод с использованием CIM-колонок (Convective Interaction Media), основанный на выделении ДНК из тестируемых продуктов с последующей ее идентификацией.
Доступность достаточного количества ДНК нужного качества является существенным фактором в тех случаях, когда для обнаружения генетически измененных организмов используются методы, основанные на полимеразной цепной реакции (PCR). Было проведено исследование по изучению возможности применения анионно-обменных монолитных CIM-колонок (Convective Interaction Media; BIA Separations, Ljubljana, Slovenia) для выделения ДНК из пищевых продуктов. В качестве пищевых препаратов были выбраны кукуруза, ее производные и продукты из них, а также предварительно термически обработанные продукты из зерен кукурузы.
Были испытаны 2 коммерческие дисковые CIM-колонки: ДЭАЭ (диэтиламиноэтил) и QA (четвертичные амины). Предварительные разделения были проведены для стандартного раствора ДНК лосося при разных значениях рН и разных концентрациях NaCl в подвижной фазе. Были выбраны ДЭАЭ – группы и рН=8 для дальнейшего выделения ДНК из сложного исходного экстракта, полученного из изучаемых продуктов. Количество и качество изолированной ДНК было протестировано с использованием электрофореза в агарозном геле, УФ-сканирующей спектрометрии и усиления PCR-методом в режиме реального времени. ДНК, полученная таким путем, была удовлетворительного качества для проведения дальнейшего PCR-анализа
Описанный метод также применим для выделения ДНК из продуктов, подвергнутых обработке, с меньшим содержанием ДНК. Следует отметить, что этот новый метод более эффективен и требует меньше времени по сравнению с существующими методами по выделению ДНК из продуктов, произведенных из ГМ-растений.
Способы выявления ГМ-ингридиентов в колбасе
Почти 90 процентов колбас содержит в себе сою. А именно это растение на сегодняшний день является лидером по генным модификациям. Соевый белок используется во многих продуктах. Если есть соя в колбасе, то вероятность того, что она генно-модифицирована, составляет около 70 процентов. Если вы видите, что на упаковке колбасы указано, что продукт не содержит сои, то это лукавство. Колбасы без сои можно сделать только в домашних условиях. В массовых производствах это невозможно.
Список использованной литературы