Курсовая работа: Генно-инженерная технология
- это любой биологический организм способный к воспроизводству или передаче генетического материала;
- содержит искусственную генетическую программу;
- получен, с применением методов генной инженерии;
В работе используется понятие «генетически модифицированные продукты (организмы)», под которыми понимаются продукты питания содержащие результаты генно-инженерной деятельности.
1. Технология ГМО
1.1 Технология получение ГМО
Процедура получения ГМО включает в себя несколько основных этапов:
• Выделение и идентификация отдельных генов (соответствующих фрагментов ДНК или РНК), которые собираются перенести другим организмам. Для этого из организмов, обладающих такими генами, с помощью специальных химических методов выделяют нуклеиновые кислоты. Их разрезают на отдельные фрагменты, используя наборы ферментов-рестриктаз. Наибольшее значение имеют рестриктазы, способные разрезать нуклеиновые кислоты с образованием, так называемых липких (комплементарных) концов. Образующиеся фрагменты имеют короткие однонитчатые концы, состоящие из нескольких нуклеотидов. Если объединить в одной пробирке фрагменты ДНК любого происхождения (н-р, фрагменты плазмид бактерий и фрагменты животной или растительной ДНК), полученные с помощью одной и той же рестриктазы, дающей липкие концы, и добавить фермент – лигазу, то эти фрагменты соединятся между собой. В результате получится химерная (рекомбинантная) ДНК, которая может содержать фрагменты ДНК, выделенные из различных организмов или синтезированную искусственно. Описанная технология позволяет создавать на основе плазмид (или других типов векторов) сложные генетические конструкции, предназначенные для переноса в клетки других организмов.
• Клонирование (размножение) переносимого гена. Чтобы размножить созданные в пробирке немногочисленные химерные молекулы ДНК, векторы со встроенными в них фрагментами необходимо перенести в реципиентные клетки. Плазмидные векторы обычно вводятся в реципиентные клетки методом генетической трансформации. Особенно широкое распространение для клонирования векторных ДНК получила трансформация клеток кишечной палочки (E. сoli), основанная на совместной инкубации «компетентных» клеток бактерий (клетки способные к трансформации) и ДНК. В результате трансформации ДНК «поглощается» бактериальными клетками и автономно размножается в их цитоплазме (внутренняя среда клетки).
На селективной среде ведут отбор трансформированных бактериальных клеток, несущих какой-либо селективный маркер, который уже был на векторе или должен был появиться в процессе образования рекомбинантной молекулы.
Если, например, вектор содержал ген устойчивости к антибиотику ампицилину, то в селективную среду, добавляют этот антибиотик, и все выжившие клетки будут содержать данный вектор. Для того, чтобы выяснить, несут ли трансформированные клетки рекомбинантную ДНК, из клеток выделяют векторную плазмиду и подвергают её электрофорезу. Метод электрофореза основан, на принципе перемещения веществ в электрическом поле от одного полюса к другому со скоростью, зависящей от их размеров. С помощью этой простой техники можно в агарозном геле разделить, идентифицировать и очистить фрагменты векторной ДНК различной молекулярной массы.
• Перенос гена (или трансгенной конструкции) внутрь клетки и встраивание его в ДНК реципиентного организма. Основной способ переноса генов (генных конструкций) из клеток организма–донора в клетки организма–реципиента - это процесс трансформации. Трансформация включает в себя несколько основных этапов и требует соблюдения ряда условий: наличия трансформирующей ДНК; «компетентных» клеток; интеграции донорской (трансформирующей) ДНК в ДНК реципиента и экспрессии (работы) перенесённых генов. Существуют различные методы трансформации: путем гибридизации соматических клеток; инкубации реципиентных клеток с чужеродным генетическим материалом; микроинъекцией генетического материала в ядра клеток животных и др. Их применение, прежде всего, зависит от биологических особенностей организма – реципиента. Например, для трансформации клеток растений используют два основных метода (рис. 1).
1) Метод биологической баллистики. В этом случае, на мельчайшие частицы вольфрама или золота напыляется ДНК, содержащая «целевой» ген. Затем эти частички с ДНК помещают в так называемую генную «пушку». В результате «выстрела» они с огромной скоростью «бомбардируют» клетки растений, проникая в их цитоплазму и ядра. Некоторые из этих клеток встраивают «целевой» ген в свою ДНК. Из каждой такой клетки может быть регенерировано новое трансгенное растение.
2)Трансформация растения с помощью, так называемой, Ti – плазмиды, несущей «целевой» ген, который доставляется в клетки с помощью почвенной бактерии (Agrobacterium tumifaciens). Ti–плазмида - это кольцевая молекула ДНК содержащаяся в клетках Agrobacterium tumifaciens, вызывающей образование опухолей у растений при их заражении этой бактерией. При заражении бактериями растений, небольшой фрагмент Ti–плазмиды встраивается в геном растительных клеток, вызывает нарушение гормонального баланса и переход к неконтролируемому делению и росту, что и приводит к образованию опухоли.

Рис.1 Методы получения ГМО
«Целевой» ген, способный изменять то или иное свойство растения, встраивается генно-инженерными методами в Ti–плазмиду, которая, затем переносится в агробактерию. В процессе совместного культивирования агробактерии и культуры клеток растения – хозяина Ti–плазмида попадает в клетки растений, а «целевой» ген с дополнительными фрагментами ДНК встраивается в растительный геном. Каждая такая клетка может быть, затем регенерирована в целое трансгенное растение, которое будет содержать генетическую информацию из двух или нескольких различных организмов. Это метод применяется для трансформации двудольных растений.
Однако этот метод "работает" не на всех растениях: агробактерия, например, не заражает такие важные пищевые растения, как рис, пшеница, кукуруза. Поэтому разработаны и другие способы. Например, можно ферментами растворить толстую клеточную оболочку растительной клетки, мешающую прямому проникновению чужой ДНК, и поместить такие очищенные клетки в раствор, содержащий ДНК и какое-либо химическое вещество, способствующее ее проникновению в клетку (чаще всего применяется полиэтиленгликоль). Иногда в мембране клеток проделывают микроотверстия короткими импульсами высокого напряжения, а через отверстия в клетку могут пройти отрезки ДНК. Иногда применяют даже впрыскивание ДНК в клетку микрошприцем под контролем микроскопах [5].
• Выявление трансгенных клеток (организмов). Процесс переноса и включения в генетический материал клеток растений чужеродной ДНК происходит с достаточно небольшой частотой, в лучшем случае трансформированной оказывается 1 клетка на 1000. Поэтому необходимо каким-то образом отделить такие клетки от остальных создать для их деления и развития наиболее благоприятные условия. В этом случае вместе с «целевым» геном (н-р, устойчивости к гербицидам, вирусам и насекомым – вредителям) вводят и второй, так называемый селективный ген. Чаще всего для этого используют гены устойчивости к антибиотикам. Если после введения чужеродной ДНК поместить клетки на питательную среду с антибиотиком, то на ней способны будут расти только трансформированные клетки [6].
1.2 Методы идентификации трансгенов
Увеличение использования ГМО и их компонентов в производстве продуктов питания, сельскохозяйственных кормов и фармацевтических препаратов делает всё более актуальным вопрос разработки эффективных методов идентификации трансгенной ДНК. В настоящее время наиболее разработаны и широко применяются методы обнаружения фрагментов чужеродной ДНК, основанные на использовании различных видов ПЦР (полимеразная цепная реакция).
ПЦР – это метод, который позволяет проверить генетический материал, выделенный из исследуемого образца, на наличие в его составе участка чужеродной или измененной ДНК и используется для получения множества копий непротяженных участков ДНК, специфичных для каждого конкретного белка, а также исследуемого генетически обусловленного признака.
В основе метода ПЦР лежит способность хорошо известных в молекулярной биологии ферментов, ДНК-полимераз, осуществлять направленный синтез второй, т.е. комплементарной (спаренной) цепи ДНК, по имеющейся матрице одноцепочечной ДНК, наращивая небольшую олигонуклеотидную затравку (праймер), комплементарную участку этой матрицы, до размеров в несколько тысяч или даже десятков тысяч звеньев. Повышая температуру, можно добиться остановки реакции и последующей денатурации полученной ДНК, т.е. разделения цепей полученной в ходе реакции двуцепочечной ДНК. Если в реакционной смеси присутствует избыток праймера, то, значительно снизив температуру, чтобы праймер мог вновь связаться с тем же самым комплементарным участком ДНК, и добавив новую порцию фермента, можно вновь установить температуру, необходимую для реакции полимеризации, и, таким образом, проведя реакцию еще раз, увеличить количество ранее полученного продукта. Многократное, или как говорят, циклическое повторение этой процедуры позволяет наработать значительное количество копий участка ДНК, начинающегося с данного праймера. Один цикл ПЦР осуществляется за 1–2 мин, так что в течение нескольких часов можно получить 100 млрд. копий (рис. 2).
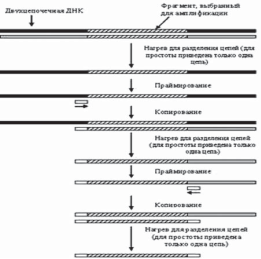
Рисунок 2. Метод ПЦР
Кроме описанного метода ПЦР, для выявления трансгенных фрагментов ДНК используется целый ряд других методов: