Курсовая работа: Гипотеза мира РНК
К достаточно давно определенным каноническим функциям РНК относятся: способность выполнять роль мессенджера при передаче наследственной информации о структуре белка от ДНК к белоксинтезирующему аппарату клеток (мРНК), участвовать в формировании структуры рибосом (рРНК), обеспечивать специфическое акцептирование и перенос аминокислот к рибосомам (тРНК).
Вместе с тем РНК свойственны особые неканонические функции, реализуемые на разных этапах программы жизни тех или иных организмов.
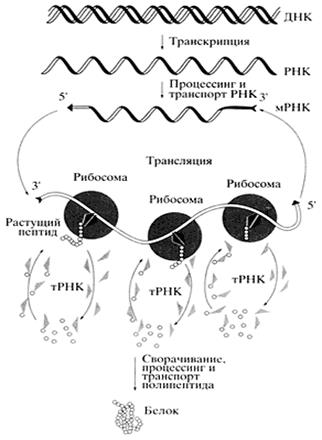
Рис. 4 Общая схема биосинтеза белка (Цитировано по Спирину А.С.)
В биосинтезе белка (трансляции) РНК безусловно играет определяющую роль. Различные по структуре рРНК формируют основу субчастиц рибосомы и определяют взаимодействие субчастиц при сборке полной рибосомы. Присоединение мРНК к рибосоме детерминируется комплементарным взаимодействием определенных участков мРНК и рРНК. Активация аминокислот, их специфическое акцептирование и доставка к рибосомам осуществляется тРНК. Кодон-антикодоновое взаимодействие между мРНК и тРНК обеспечивает перевод нуклеотидной последовательности информационных макромолекул в аминокислотную последовательность синтезируемых белков. Сама реакция образования пептидной связи (транс-пептидирование) и продвижение рибосомы по мРНК (транслокация) также, по всей видимости, связаны с функционированием рРНК. Пространственная структура мРНК непосредственно влияет на скорость трансляции, а ее способность взаимодействовать с разнообразными регуляторными белками, особенно характерная для высших эукариот, является основой для тонкой регуляции биосинтеза белка.
При «включении» гена происходит локальное расплетение спирали ДНК. Затем с гена, кодирующего белковую молекулу, синтезируется его РНК-копия. После ряда «превращений» она становится матричной РНК, т. е. матрицей для синтеза белка. мРНК переносится из ядра клетки в цитоплазму, где связывается с рибосомами, на которых и «производится» белок. Он синтезируется из активированных аминокислот, присоединенных к специальным транспортным РНК.
В процесс трансляции вовлечено множество макромолекул и макромолекулярных комплексов. При трансляции происходит считывание генетической информации, заключенной в мРНК, рибосомами и ее передача полипептидным цепям белков, т.е. биосинтез полипептидных цепей, последовательность аминокислот в которых определена последовательностью нуклеотидов в мРНК в соответствии с генетическим кодом.
Свободные аминокислоты не узнаются рибосомами. Чтобы это произошло, аминокислоты должны поступать в рибосомы в виде конъюгатов с тРНК (аминоацилированных тРНК), последовательности нуклеотидов которых распознаются аппаратом трансляции. В каждой молекуле тРНК имеется участок из трех нуклеотидов, комплементарный кодону мРНК. Именно эта последовательность, называемая антикодоном, определяет положение аминокислоты в полипептидной цепи. В ходе каждого индивидуального акта трансляции рибосома распознает кодон мРНК и в соответствии с ним выбирает аминоацилированную тРНК, антикодон которой соответствует транслируемому кодону. После этого происходит соединение посредством пептидной связи очередной аминокислоты с С-концевой аминокислотой растущей цепи полипептида.
Таким образом, во время трансляции рибосома после связывания мРНК начинает последовательно, кодон за кодоном, перемещаться вдоль матрицы, выбирая из окружающей среды молекулы аминоацилированных тРНК. При этом каждый индивидуальный акт трансляции завершается присоединением выбранной молекулы аминокислоты к С-концевой аминокислоте синтезируемой цепи белка посредством пептидной связи.
Процесс биосинтеза белка рибосомами, как и биосинтез любой другой макромолекулы клетки, условно разделяют на три этапа: инициацию, элонгацию и терминацию.
Во время инициации трансляции происходит сборка нативной 70S или 80S рибосомы на транслируемой мРНК и подготовка к образованию пептидной связи между первыми двумя N-концевыми аминокислотными остатками синтезируемого полипептида.
При элонгации происходит последовательное удлинение растущей цепи полипептида аминокислотными остатками, а терминация трансляции сопровождается прекращением синтеза полипептида и его высвобождением из трансляционного комплекса. При этом наблюдается разделение рибосомы и мРНК, после чего они вступают в новый цикл трансляции.
В ходе трансляции рибосома последовательно перемещается вдоль транслируемой молекулы мРНК, считывая заключенную в ней генетическую информацию в виде триплетного генетического кода. Трансляция начинается в 5'-концевой части мРНК, а завершается в ее 3'-концевой части. При этом биосинтез полипептида начинается с его N-концевой аминокислоты [3].
РНК участвуют в репликации ДНК, выступая в роли затравок (праймеров), необходимых для инициации синтеза комплементарных цепей ДНК. Особая «антисмысловая» РНК (РНК I) выполняет роль регулятора инициации репликации ДНК в точках начала репликации, обладая возможностью связывать праймеры и тем самым останавливать биосинтез ДНК.
В процессе транскрипции (биосинтезе РНК на матрице ДНК) большое значение имеет способность РНК образовывать разнообразные элементы вторичной структуры (шпильки), которые влияют как на инициацию, так и на терминацию синтеза РНК. РНК активно участвует в процессе своего собственного созревания — процессинге первичных транскриптов (про-РНК). У примитивных одноклеточных организмов выявлена способность РНК к аутостайсингу — вырезанию некодирующих участков (интронов) и сшиванию кодирующих фрагментов (экзонов) без участия белков-ферментов. У организмов, утративших способность к аутосплайсингу, в сплайсировании РНК тем не менее принимают участие особые молекулы — малые ядерные РНК (мяРНК), необходимые для безошибочного вычленения интронов из молекул РНК-предшественников.
Посттрансляционные модификации синтезированных в ходе трансляции полипептидов, в результате которых образуются функционально активные молекулы, также нередко сопряжены с присоединением к ним значительных по размерам молекул РНК. Таким путем возникают РНК-содержащие ферменты — рибонуклеопротеины - комплекс РНК и белка; среди рибонуклеопротеинов наибольшей функциональной значимостью обладают информосомы, а также РНП-частицы, участвующие в процессинге мРНК (сплайсомы, РНКаза и др.), теломеразы.
Информосомы, частицы, присутствующие в животных клетках и состоящие из высокомолекулярной (нерибосомной) рибонуклеиновой кислоты (РНК) и особого белка. Информосомы обнаружены впервые советским биохимиком А. С. Спириным с сотрудниками в 1964 в цитоплазме зародышей рыб, где они представлены смесью частиц разных размеров Отношение массы РНК к массе белка в информосомах постоянно (около 1:4) и одинаково у всех частиц, независимо от их размера. Аналогичные частицы найдены в клетках млекопитающих, в том числе зараженных вирусами, а также у иглокожих и насекомых. В них содержится, по-видимому, информационная РНК (иРНК) - отсюда название. Белок информосом служит, вероятно, для переноса иРНК из ядра в цитоплазму, а также для защиты иРНК от разрушения и регуляции скорости белкового синтеза.
Малые ядерные РНК присутствуют в ядрах в комплексах с белками, получившими название малые рибонуклеопротеиновые частицы (мяРНП). Стабильным компонентом мяРНП является белок фибрилларин — очень консервативный по структуре белок с молекулярной массой 34 кДа, локализованный в ядрышках. Комплекс, состоящий из множества мяРНП, который катализирует сплайсинг ядерных про-мРНК, носит название сплайсингосомы. Сплайсингосома собирается на интроне перед его выщеплением и содержит несколько различных мяРНП. Малые ядерные РНП собираются в сплайсингосомы в определенной последовательности.
И наконец, нельзя обойти вниманием тот факт, что многие катализаторы белковой природы (ферменты), катализирующие различные биохимические превращения в клетке, функционируют благодаря содержанию в них коферментов рибонуклеотидной природы (NAD, FAD, АТР и др.).
I.3 тмРНК
Помимо основных видов РНК существует особый вид - тмРНК (10Sа РНК) - небольшая стабильная молекула, совмещающая в себе свойства транспортной и матричной РНК. Хотя тмРНК была открыта более 20 лет назад в пост-рибосомном супернатанте, полученном из клеток Escherichiacoliее функция была установлена тольков 1996 году. тмРНК Е. coliсостоит из 363 н. В современной модели вторичной структуры тмРНК Е. coli, основанной на сравнительном филогенетическом анализе нуклеотидных последовательностей тмРНК из 50 организмов, можно выделить три района. Первый включает 3'- и 5'-концы молекулы и образует тРНК-подобную структуру, состоящую из аминоакцепторного стебля и ТΨС-шпильки. Второй район представляет собой одноцепочечный участок, кодирующий tag-пептид, а третий соединяет тРНК - и мРНК-подобные части молекулы. Этот район сильно структурирован и содержит четыре псевдоузла (рк1, рк2, рк3 и рК4).
Матричная часть тмРНК кодирует пептид, являющейся сигналом узнавания специфическими протеазами (tag-пептид). тРНК-подобная часть может быть аминоацилирована. В аминоацилированном состоянии тмРНК взаимодействует с рибосомой, запрограммированной мРНК, в которой в результате случайной деградации отсутствует стоп-кодон. В результате такие рибосомы оказываются "арестованными", они не могут освободиться от мРНК, тРНК и пептида и не могут участвовать в трансляции нужных клетке мРНК. После взаимодействия с тмРНК трансляция переключается на матричную часть этой РНК, что приводит к считыванию tag-пептида, кодируемого матричной частью мРНК. В результате tag-пептид присоединяется к недосинтезированному пептиду, который содержится в рибосоме до ее взаимодействия с тмРНК. При этом происходит терминация трансляции на стоп-кодоне матричной части тмРНК, а пептид, освободившийся из рибосомы, содержит участок, узнаваемый специфическими протеазами, что способствует его быстрой деградации.
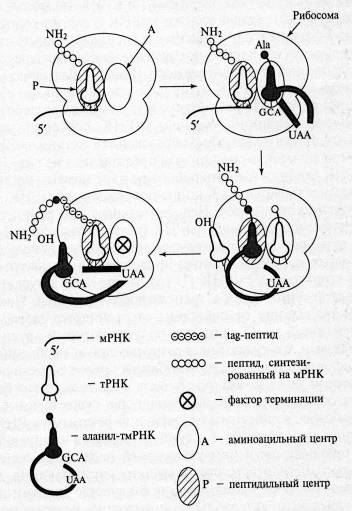
Рис. 5. Схема транс-трансляции (Цитировано по Зверевой М.Э. и соавт.)
В 1996 г. Кейлер предложил в качестве механизма функционирования тмРНК модель транс-трансляции (биосинтез полипептидной цепи белка с использованием различных матричных последовательностей). Она предлагает механизм синтеза дополнительного пептида, основанный на наблюдении, что добавление нового пептида происходит в случае трансляции мРНК, в которой отсутствует стоп-кодон. Согласно этой модели, заряженная аланином тмРНК входит в А-центр рибосомы тогда, когда трансляция останавливается на З'-конце поврежденной мРНК, не содержащей стоп-кодон. Остановившаяся пептидная цепь переносится на аланил-тмРНК (реакция транспептидирования), и рибосома продолжает синтез по матричной части тмРНК. Синтез продолжается до поступления в А-центр стоп-кодона тмРНК, после чего вступает в действие фактор терминации и трансляция завершается. В результате гибридный белок, состоящий из пептидов, соединенных аланином из тмРНК, уходит из рибосомы, а освободившаяся рибосома может участвовать в синтезе другого белка.
Особенность такой транс-трансляционной системы состоит в том, что одна пептидная цепь синтезируется с двух различных молекул мРНК. Необходимо отметить, что способ установления рамки считывания (ОРС) матричной части тмРНК отличен от всех известных способов установления рамки считывания. Первая включаемая аминокислота не определена обычным кодон-антикодоновым взаимодействием, а аденозиновый остаток, отстоящий на 3 н. в 5'-направлении от первого транслируемого кодона, важен для транс-трансляции. В природных тмРНК этот аденозин находится в центре таких триплетов, как UАА и UАG, которые обычно узнаются с помощью фактора терминации. Возможно, для установления правильной ОРС тмРНК необходим фактор терминации. Это предположение требует дальнейшего экспериментального подтверждения.
С помощью тмРНК клетка решает две задачи: с одной стороны, освобождаются остановившиеся рибосомы, а с другой, неправильные белки быстро расщепляются специфической протеазой, узнающей сигнальный пептид, кодируемый матричной частью тмРНК. тмРНК активно исследуется на протяжении последних лет. Это связано с открытием процесса транс-трансляции, а именно с возможностью синтеза одного белка на основе двух различных мРНК. Способность тмРНК объединять в одной молекуле функции тРНК и мРНК и присоединять аланин из тРНК-части без обычного кодон-антикодонового взаимодействия делает тмРНК интересным объектом исследований. Кроме того, отсутствие тмРНК у высших организмов указывает на возможность ее использования в качестве хорошей мишени при создании новых антибактериальных средств. Функция тмРНК особенно важна для жизнедеятельности бактерий при повышенных температурах. Известно, что многие бактериальные инфекции сопровождаются повышением температуры, поэтому создание препарата, блокирующего функцию тмРНК, приведет к гибели бактерий и не повлияет на биосинтез белков человека.
I.4 Интерференция РНК
Одним из наиболее важных механизмов регуляции экспрессии генов является интерференция РНК. Регуляция экспрессии эукариотических генов может осуществляться на нескольких уровнях: во время транскрипции, на стадии процессинга РНК, при трансляции и на уровне созревания белка. В последнее время в связи с открытием явления интерференции РНК большое внимание ученых привлекает посттранскрипционный уровень регуляции.