Курсовая работа: Химическая классификация минералов
5. Силикаты и их аналоги
Класс силикатов и их аналогов является самым большим по числу минеральных видов – к нему относится 30% от их общего числа. В целом силикаты и алюмосиликаты слагают около 75 об.% земной коры, при этом наиболее распространены полевые шпаты – на их долю приходится около 40-45 об.% литосферы. За ними по распространенности следуют слюды, пироксены, амфибиолы и гранаты. В соответствии с распространенностью химических элементов главными катионами в силикатах и их аналогах являются K, Na, Ca, Mg, Fe. Значительна также роль алюминия, который, как показали рентгеноструктурные исследования, может выступать как в качестве катиона, так и входить в анионный радикал минералов.
Выявлены следующие черты строения силикатов и их аналогов.
1. Во всех силикатах атомы кремния имеют по отношению к кислороду четверную координацию, они образуют вместе с кислородом, как в кварце, кремнекислородные тетраэдры (SiO4 )4- (cм. рис. 1). Связи кремния с кислородом смешанные ионно-ковалентные, с разной степенью ионности в минералах разной структуры и с разными катионами.
2. Кремнекислородные тетраэдры могут быть одиночными, и тогда они соединяются в общей структуре минерала через катионы, но могут и полимеризоваться, образуя различные анионные группировки.
3. Алюминий в силикатах может быть катионом, занимая позиции в октаэдрических пустотах между кислородом, и может входить в тетраэдры (AlO4 )5- , занимая в структуре минералов позиции, адекватные с кремнием. Например, в каолините Al2(Si2O5)(OH)4 алюминий является катионом и имеет координационное число шесть, а в микроклине K(AlSi3O8) он входит в анионный радикал минерала. Есть минералы, в которых алюминий представлен и как катион и входит в анионный радикал, например в слюде мусковите KAl2(AlSi3O10)(OH)2.Размер тетраэдров (AlO4 )5- и его конфигурация иные, чем у групп (SiO4 )4- , характер химических связей также отличен. Поэтому имеется предел замещения Si4+ Al3+
Установлено, что в силикатах может замещаться алюминием не более половины кремния в тетраэдрах. Значит, предельны по составу алюмосиликаты типа анортита Ca(Al2Si2O8), нефелина Na(AlSiO4) и т. п.
4. Помимо кремнекислородных анионных радикалов во многих силикатах и алюмосиликатах есть дополнительные анионы - OH- , (CO3 )2- ,(SO4 )2- ,(S2 )2- , (BO3 )3- , (P2 O7 )4- и др.
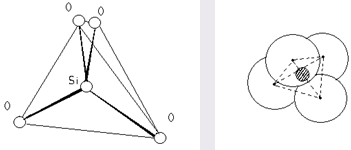
Рис. 1. Тетраэдр (SiO4 ) в двух изображениях.
Классификация силикатов и их аналогов производится по их структурам. Так выделяют шесть подклассов: островные, кольцевые, цепочечные, ленточные, слоистые, каркасные.
5.1 Островные силикаты
Среди силикатов это наиболее многочисленный подкласс минералов. Его характерными представителями являются оливин (Mg, Fe)2(SiO4 ), альмандин Fe3 Al2 (SiO4 )3 , гроссуляр Ca3 Al2 (SiO4 )3 , топаз Al2 (SiO4 )F2 , эпидот Ca2 (Al,Fe)(SiO4 )(Si2 O7 )O(OH). Силикаты это подкласса имеют разнообразный состав – это минералы магния, железа, кальция, марганца, титана, алюминия, редких земель, тория, циркония, ниобия и др., ни в одном другом подклассе нет такого разнообразия катионов. К этому подклассу относятся также совсем особые по составу и структуре минералы, очень редкие в природе – это силикофосфаты, в них имеются дополнительные радикалы (P2 O7 )4- и (PO4 )3- (например, ломоносовит с приблизительной формулой Na5 Ti2 (Si2 O7 )(PO4 )O2 и силикокарбонаты (сперрит Ca5 (SiO4 ) 2 (CO3 ) и др.)).
Кристаллохимическое своеобразие минералов подкласса островных силикатов определяется сочетанием двух факторов: а) присутствием в них орто- и диортогрупп - (SiO4 )4- и (Si2 O7 )6- , б) большой ролью в их составе катионов октаэдрической координации с радиусом от 0,060 до 0,080 нм (Ti4+ -0,064; Fe3+ -0,067; Nb5+ -0,069; Mg2+ -0,078; Fe2+ -0,082 нм, по В. Гольдшмидту), главными из них являются магний и железо. Благодаря такому сочетанию типичных для плотнейшей упаковки её тетраэдрических и октоэдрических полиэдров, структуры островных силикатов наиболее компактны и прочны среди силикатов других подклассов. Кроме перечисленных катионов большую роль, но не во всех, а в некоторых островных силикатах играют относительно крупные катионы восьмерной (и более) координации – Ca2+ (0,016 нм), Na+ (0,098 нм), Ce3+ (0,018 нм). Их координационные полиэдры несоразмерны с октаэдрами и тетраэдрами. Структура таких минералов, за малым исключением (гроссуляр), менее компактна.
Характерная особенность алюминия в островных силикатах заключается в том, что он всегда занимает октаэдрические позиции и является в этих силикатах катионом. Разнообразие катионов, их разные радиусы и свойства приводят к усложнению кристаллических структур островных силикатов и часто к вхождению в них дополнительных анионов F- и (OH)- . Особенно характерны такие анионы для силикатов, содержащих одновременно группы (SiO4 )4- и (Si2 O7 )6- и резко различающиеся по металлическим свойствам катионы: Ca2+ и Ti4+ (титанит), Ca2+ и Al3+ (эпидот), K+ , Na+ и Ti4+ (лампрофиллит). Дополнительные анионы характерны также для силикатов, в состав которых входят только группы (SiO4 ) и алюминий в качестве катиона, - топаз Al2 (SiO4 )F2 , кианита Al2 (SiO4 )Oи др.
Перечень главнейших островных силикатов приведен в табл. 4.
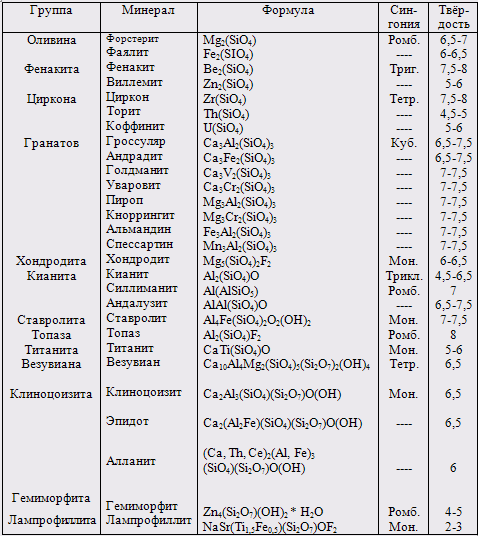
Таблица 4. Главные минералы – островные силикаты
Островные силикаты образуются даже в стесненных условиях роста в виде хороших кристаллов. Это объясняется их большой силой кристаллизации, что обусловлено относительной компактностью и простотой структур этих силикатов, многозарядностью анионных комплексов и значительной силой связей катионов, входящих в их состав. Островные силикаты обладают высокой степенью идиоморфизма (совершенства) кристаллов.
Окраска островных силикатов обычно обусловлена присутствием в их составе в качестве главных и примесных компонентов элементов-хромофоров (Fe, Mn, Ti и Cr). Атомы двух- и трёхвалентного железа вызывают при разных своих соотношениях зелёные (гроссуляр, эпидот), коричневые (андрадит, ставролит, титанит) цвета. Лишь в редких случаях встречаются бесцветные, белые островные силикаты – это химически чистые гроссуляр, форстерит, топаз каламин.
Компактность структуры и наличие в минералах небольших, но высокозарядных катионов проявляются в высокой плотности и твёрдости (от 6 до 8) этих минералов. Из-за большой твердости эти минералы черты не дают (они процарапывают бисквитную пластинку), даже у густо окрашенных минералов она чуть заметна.
5.2 Кольцевые силикат
Подкласс островных силикатов объединяет сравнительно небольшое число редких в природе минералов. Среди них только два минерала – турмалин и берилл – играют в некоторых случаях роль второстепенных, а иногда и даже главных минералов ряда минеральных месторождений.
Главными структурными элементами кольцевых силикатов являются одно- или двухъярусные тройные, четверные, шестерные, девятерные кольца тетраэдров. Турмалин и берилл характеризуются шестерными одноярусными кольцами, но разной конфигурации. В турмалине все тетраэдры в кольце лежат своими основаниями в одной плоскости, вершины обращены в одну сторону, сечение кольца не просто шестиугольное, а дитригональное. В структуре минерала кольца ориентированы одинаково – вершинами тетраэдров вверх, структура получается резко асимметричной по строению и свойствам, а кристалл турмалина имеет дитригональное сечение и не одинаковые концы. Они растут с неодинаковой скоростью, по-разному адсорбируют вещества, в том числе пигментирующие изоморфные примеси, и потому разные концы кристалла нередко различны по цвету; из-за асимметрии структуры в турмалине хорошо проявлен пироэлектрический эффект. В бериллах кольцо гексагональное с горизонтальной плоскостью симметрии, оба конца кристаллов берилла одинаковые по огранке и своим свойствам.
В целом структуры кольцевых силикатов сложные и не плотные. Сингония минералов определяется геометрией их колец. Преобладают тригональные и гексагональные минералы.
Таблица 5. Главные минералы – кольцевые силикаты.
| Группа | Минерал | Формула | Син-гония | Твер-дость |
| Турмалина |
Шерл Рубеллит |
NaFe3 Al6 (Si8 O18 )(BO3 )3 (OH)4 Na(Li1,5 Al1,5 )Al6 (Si6 O18 )(BO3 )3 (OH)4 |
Триг. ---- |
7-7,5 7-7,5 |
|
Берилла Эвдиалита Кордиерита |
Берилл К-во Просмотров: 1013
Бесплатно скачать Курсовая работа: Химическая классификация минералов
|