Курсовая работа: Хімічні джерела струму
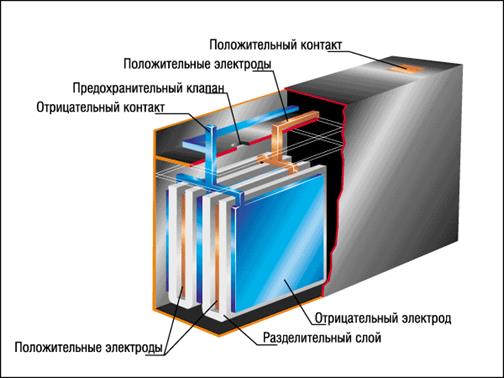
Малюнок 2. Загальна будова акумулятору
Найбільш широко використовують кислотний свинцевий, лужний кадмієво - нікелевий та лужний срібно - цинковий акумулятори.
2.3.1 СВИНЦЕВИЙ КИСЛОТНИЙ АКУМУЛЯТОР
Свинцевий кислотний акумулятор в зарядженому стані являє собою елемент:
(-) Pb, PbSO4(т) | H2SO4 (32-34%) | PbO2, Pb (+)
при роботі якого протікають наступні електродні реакції: на лівому катоді:
![]()
на правому електроді:
![]()
сумарна реакція процесу:
![]()
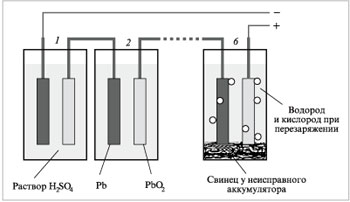 |
Малюнок 3. Схема дії свинцевого акумулятору
Ізобарний потенціал цієї реакції відображає зникнення твердих свинцю і його діоксину, виникнення твердого сульфату свинцю, а також зникнення 2 моль сірчаної кислоти і виникнення 2 моль води:
![]()
Так як хімічні потенціали твердих фаз постійні (при даних температурі і тиску), то
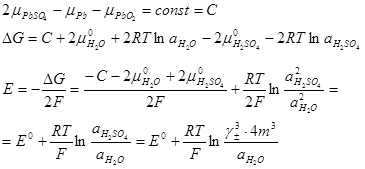
Ізобарний потенціал і ЕРС акумулятора залежать від концентрації сірчаної кислоти (точніше - від активності компонентів розчину).
У процесі розряду акумулятора концентрація сірчаної кислоти зменшується, а при зарядженні збільшується.
2.3.2 КАДМІЄВО-НІКЕЛЕВИЙ ЛУЖНИЙ АКУМУЛЯТОР
Цей акумулятор у зарядженому стані являє собою електрохімічний елемент:
(-) Cd | Cd(OH) 2, KOH (20%) || KOH (20%), Ni(OH) 2, Ni(OH) 3/Ni (+)
Сумарна реакція і цьому елементі:
Cd + 2Ni(OH) 3 = Cd(OH) 2 + 2Ni(OH) 2![]()
Значення ![]()
![]() для цієї реакції не повинно залежати від концентрації лугу, так як в сумарній реакції приймають участь тільки тверді речовини. Однак реакції на електродах супроводжуються зміною концентрацією лугу і утворенням різниці концентрації у двох електродів:
для цієї реакції не повинно залежати від концентрації лугу, так як в сумарній реакції приймають участь тільки тверді речовини. Однак реакції на електродах супроводжуються зміною концентрацією лугу і утворенням різниці концентрації у двох електродів:
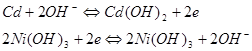
Ця різниця повинна визначати концентраційну поляризацію, котра зменшує ЕРС елементу. Однак в результаті перемішування в умовах близькості електродів ця різниця концентрацій практично не виникає.
ЕРС кадмієво - нікелевого акумулятора рівна приблизно 1,36 В. Використовуються такі лужні акумулятори, в яких кадмій і оксид кадмію замінюють залізом та закисним залізом.
2.3.4 СРІБНО - ЦИНКОВИЙ ЛУЖНИЙ АКУМУЛЯТОР
Анодом є пориста цинкова пластинка, катодом оксиди срібла Ag2O і AgO, отримані електролітичним окисненням металічного срібла. Електроліт - концентрований розчин КОН, насичений цинкатом калія Zn(OK) 2. Заряджений акумулятор може бути представлений у вигляді:
(-) Zn | Zn(OK) 2 + KOH(40%) | Ag2O або AgO | Ag (+)
Сумарна реакція в цьому елементі