Курсовая работа: Кинетика химических реакций
Г = Z * вс / ( l + вс), (19)
где Z - число мест на адсорбенте; в - постоянная, зависящая от температуры.
При полном заполнении поверхности адсорбента молекулами
адсорбата Z = Г0 предельной адсорбции. После подстановки в уравнение (19) и последующих преобразований его можно представить в линейной, удобной для графического представления, форме:
С / Г = (1/вГ0 ) + (С / Г0 ). ( 20)
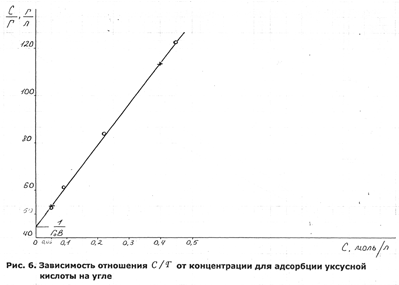
Если наш случай описывается изотермой Лангмюра, то в координатах С / Г = f ( c) график должен представлять прямую. По данным табл.2.6 строим график (Рис.6).
Вид графика подтверждает наше предположение. Из графика определим постоянные:
Г0 = ctga = 5,8 * 10-3 , моль / г; 1/Г0 В = 45, B = 1/ (45 * 5,8 * 10-3 ) = 3,83
Таким образом, изотерма адсорбции Лангмюра для рассматриваемого случая при 200 С имеет вид:
Г = 5,8 * 10-3 * 3,83С / (1 + 3,83С) ( 21)
Перейдем к определению равновесной концентрации C5 при исходной концентрации раствора C05 = 0,56 моль / л .,
В соответствии с уравнениями (18 ) и (21 ) можно записать:
Г5 = ( C05 - C5 ) / 20 = (0,56 - C5 ) / 20
Приравняв правые части, решим полученное уравнение относительно C5:
(0,56 - С5 ) / 20 = 5,8 * 10-3 * 3,83С / (1 + 3,83С)
![]()
(0,56 - С5 ) (1 + 3,83С) = 5,8 * 10-3 * 3,83С * 20
3,83С5 2 - 0,71С5 - 0,56 = 0
Равновесная концентрация C5 = 0,484 моль / л .
3. Исходные данные
Вариант и номер задания расчетно-графической работы.
Работа №1
Таблица 3.1
| Вариант | 1 | ||
| Номер задания | 9 | ||
| Кислота | Дихлороуксусная (CCl2 COOH ) | ||
|
Исходные данные |
C'm , моль / кг | -E0, B |
Cm , К-во Просмотров: 628
Бесплатно скачать Курсовая работа: Кинетика химических реакций
|