Курсовая работа: Лантаноиды
Табл. 5. Стандартные электродные потенциалы лантаноидов
| Лантаноид | φ° 298, эв |
| Лантан | -2,52 |
| Церий | -2,92 |
| Празеодим | -2,46 |
| Неодим | -2,43 |
| Прометий | -2,42 |
| Самарий | -2,41 |
| Европий | -2,40 |
| Гадолиний | -2,40 |
| Тербий | -2,34 |
| Диспрозий | -2,35 |
| Гольмий | -2,32 |
| Эрбий | -2,30 |
| Тулий | -2,38 |
| Иттербий | -2,27 |
| Лютеций | -2,25 |
Поэтому все лантаноиды взаимодействуют с водой с выделением водорода:
2Ме + 6Н2О → 2Ме(ОН)3 + 3Н2 ↑
Се + 2Н2О → СеО2 + 2Н2 ↑
Реагируя с водой, только европий образует растворимый кристаллогидрат жёлтого цвета, который при хранении белеет. По – видимому, здесь происходит дальнейшее разложение до оксида европия (III).
2Eu + 10H2O → 2Eu(OH)3•2H2O + 5H2↑
2Eu(OH)3•2H2O → Eu2O3 + 5H2O
Химическая активность простых веществ лантаноидов очень высока, поэтому они взаимодействуют почти со всеми элементами периодической системы Д. И. Менделеева: с кислородом, галогенами, серой, углеродом, азотом, водородом, кремнием, фосфором и т. д. Причём с двумя последними реакции идут при нагревании. Химическая активность элементов в ряду Ce – Lu несколько уменьшается из-за уменьшения их радиусов.
4Ме + 3O2 200-400°С → 2Ме2O3
Се + О2 → СеО2
2Me + 3Hal2 → 2MeHal3
2Me + 3S → Me2S3
4Me + 3C → Me4C3
2Me + N2 750-1000ْ C → 2MeN
2Me + 3H2 → 2MeH3
4Me + 3Si t°C → Me4Si3
Me + P t°C → MeP
Лантаноиды благодаря положению в ряду СЭП реагируют и с кислотами – неокислителями с выделением водорода:
2Ме + 6HCl → 2МеCl3 + 3Н2 ↑
2Ме + 3H2SO4 (разб.) → Ме2(SO4)3 + 3Н2 ↑
Лантаноиды также образуют непрерывные твёрдые растворы с металлами подгруппы галлия. При взаимодействии лантаноидов, например со скандием, возникают очень прочные металлиды (рис 2)
t°C 1470°
1400 1300 1200
К-во Просмотров: 455
Бесплатно скачать Курсовая работа: Лантаноиды
|
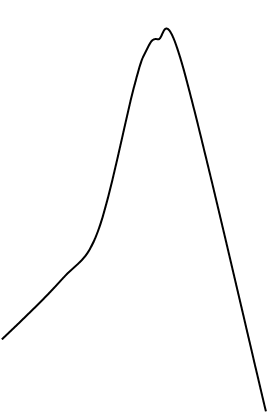
 1100 Pr2Ga3 1044°
1100 Pr2Ga3 1044°