Курсовая работа: Лекарственное растительное сырье, содержащее фенолгликозиды
Салидрозид обладает бифункциональными свойствами, т.е. проявляет себя как ингибитор или инициатор окислительных процессов. Проявление того или иного свойства зависит от концентрации салидрозида в реакционной среде- при низких концентрациях салидрозид выступает как ингибитор окислительных процессов, при высоких – как инициатор [6].
По-видимому, этими химическими свойствами салидрозида определяется и его фармакологический эффект. В опытах на мышах, в малых дозах салидрозид действует стимулирующе на спонтанную активность мышей, а при больших дозах снижает двигательную активность интактных животных. По- разному влияет салидрозид на холинергические и моноаминергические процессы в центральной нервной системе в зависимости от доз используемого препарата [4, 6].
Фенолгликозид салицин, используется в народной медицине при лихорадочных состояниях, при воспалениях слизистых ротовой полости и верхних дыхательных путей (полоскания), при кожных заболевания (примочки) [5].
Учитывая фармакологические свойства салицина и используя достижения синтетической химии в 20 столетии научными работниками разных стран мира было синтезировано значительное количество органических соединений. Они со временем нашли широкое применение в фармации и научно- практической медицине как противовоспалительные и анальгетические средства [2, 4, 5].
4. Методы выделения и идентификации
Фенольные гликозиды из растительного материала извлекают этиловым и метиловым спиртами (96, 70 и 40º). В дальнейшем очистку спиртовых извлечений ведут общепринятым для гликозидов методом [12, 13, 14, 15].
Выделение индивидуальных соединений приводят, как правило, методом адсорбционной хроматографии на полиамиде, силикагеле, целлюлозе. В качестве элюирующих смесей используется вода и водный спирт, если адсорбентом служит полиамид или целлюлоза, либо различные смеси органических растворителей для всех перечисленных адсорбентов [1, 13, 14].
Фенольные гликозиды в лекарственном растительном сырье могут быть идентифицированы хроматографией в тонком слое сорбента или на бумаге [1, 12, 13, 14].
Для хроматографирования в тонком слое сорбента используют системы растворителей: 1) n-бутанол- уксусная кислота – вода (4:1:5); 2) n-бутанол- уксусная кислота – вода-ксилол (6:2:3:4); 3)хлороформ- метиловый спирт (8:2) [1, 12, 13, 14].
При хроматографии на бумаге используют 5, 10 и 15% - ную уксусную кислоту[1].
Для индивидуальных веществ определяют t-плавления, удельное вращение, снимают УФ, ИК спектры[1, 12, 14, 15].
Рассмотрим УФ и ИК спектры на примере арбутина. В связи с наличием в молекуле фенольных гликозидов ароматических С-С связей фенольные гликозиды имеют макисмум поглощения в УФ спектре при 270-300 нм. Максимум поглощения арбутина находится при 287 нм (в составе арбутина есть остаток гидрохинона с достаточной сопряжённой системой) и может быть использован как для качественной характеристики, так и количественного определения арбутина а растительном материале. При анализе УФ-спектров у растений, содержащих арбутин можно отметить, что на них присутствуют 2 максимума поглощения, характерных для данного соединения при 220 и 284 нм, причем интенсивность (выраженность) пиков соответствует содержанию арбутина в исследуемых видах. Например, при исследовании толокнянки, брусники, зимолюбки, черники и голубики, наибольшая интенсивность пика при 220 нм характерна для толокнянки, брусники и зимолюбки, менее выражены пики в этой области для черники и голубики (рисунок 6) [12, 14].
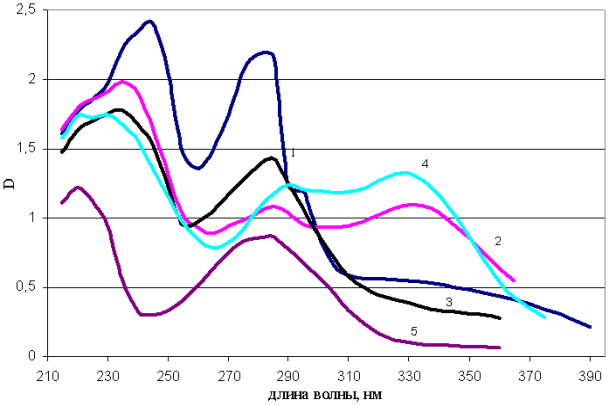 Рисунок 6 - УФ-спектры этанольных экстрактов листьев брусники (1), толокнянки (2), зимолюбки (3), черники (4) и голубики (5)
Рисунок 6 - УФ-спектры этанольных экстрактов листьев брусники (1), толокнянки (2), зимолюбки (3), черники (4) и голубики (5)
В ИК спектре арбутина имеются характерные полосы при 3200- 3400 смˉ¹, обусловленные наличием спиртовых и фенольных гидроксильных групп; полоса 1515,1460 , 1440 смˉ¹ типична для С=С- связей. Имеется ряд полос в области 800-1300 смˉ¹ (область “отпечатка пальцев”). Совпадение спектров исседуемого гликозида со спектром достоверного образца указывает на идентичность соединения. Для идентификации фенольных гликозидов широко используются химические превращения, анализ, ацетилирование, метилирование и т.д. и сравнение продуктов превращения с литературными данными для предполагаемого гликозида [12, 14].
Также сейчас распространяется идентификация фенолгликозидов с помощью метода ВЭЖХ [16, 20]. На рисунке ниже (риcунок 7) показана ВЭЖ-хроматограмма водного экстракта зимолюбки зонтичной, на которой по УФ-спектрам в сравнении с достоверным образцом идентифицирован арбутин. В данном конкретном случае, анализ проводился на высокоэффективном жидкостном хроматографе «Миллихром-А-02» с последующей компьютерной обработкой результатов исследования с помощью программы МультиХром-СПЕКТР для Windows. В качестве неподвижной фазы использовали колонку ProntoSIL 120-5-C18 AQ, №80303 размером 2,0×75 мм, размер частиц – 5,0 мкм; в качестве подвижной фазы – [4M LiClO4+0,1M HClO4] : H2O в соотношении 5:95. Скорость подачи элюента – 100,00 мкл/мин. Температура – 40 °C. Давление – 2,0 MPa. Продолжительность анализа – 115 мин. Параллельно с испытуемым раствором в хроматограф вводились растворы достоверных образцов арбутина, гидрохинона и рутина. Детектирование данных веществ проведены по УФ-спектрам при длинах волн 210–300 нм [14].
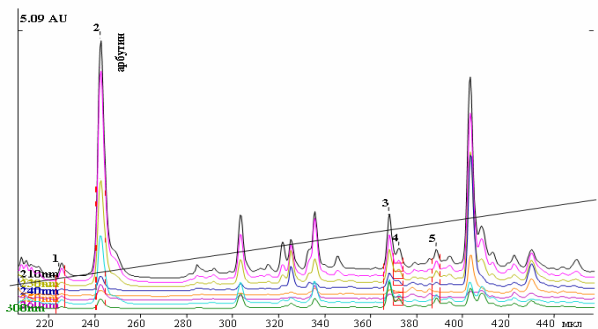
Рисунок 7 - ВЭЖ-хроматограмма водного экстракта зимолюбки зонтичной
Существенную практику препаративного выделения индивидуальных растительных соединений из-за трудоемкости технологических приемов и высокой себестоимости конечного продукта следует считать оправданной при наличии в них преобладающих компонентов [2].
5 .Качественное определение
Фенольные гликозиды, имеющие свободную гидроксильную группу, дают все реакции, характерные для фенолов, например, с железоаммониевыми квасцами, реакцию диазотирования и др [1, 11].
В случае если фенольный гидроксид гликозирован, как у салицина, реакции проводят после предварительного гидролиза гликозида кислотами или ферментами. Эти же качественные реакции используют для обнаружения фенольных гликозидов на хроматограммах [1, 13].
В случае хроматографирования в тонком слое силикагеля хроматограммы можно обработать кроме перечисленных реактивов еще и 4%- ной Н2SO4 в абсолютном этиловым спирте [13].
При этом фенольные гликозиды в зависимости от строения обнаруживаются в виде желтых, красных, оранжевых и голубых пятен [13].
При обработке хроматограмм раствором нитрата серебра и щелочью фенольные гликозиды обнаруживаются в виде коричневых пятен с различными оттенком [1, 13].
При обработке хроматограмм реактивом Паули фенольные гликозиды в зависимости от строения проявляются в виде желтых, оранжевых или красных пятен [1, 13].
6. Методики обнаружения фенольных гликозидов
Ниже я приведу некоторые возможные методики обнаружения фенольных гликозидов в ЛРС, описанные в литературе и НД [1, 2, 8, 12-15].
1. 0.5 гр измельченного сырья кипятят с 10 мл Н2О 2-3 минуты и после охлаждения фильтруют. К 1 мл фильтрата прибавляют кристаллик сульфата закисного Fe, жидкость окрашивается сначала в сиреневый, затем темно- фиолетовый цвет, и наконец, образуется темно- фиолетовый осадок (арбутин) [1].
2. К 1 мл фильтрата (в фарфоровой чашке) прибавляем 4 мл раствора аммиака и 1 мл 10% раствора Na фосфорно - молибденовокислого в 10%- ной HCl; появляется синее окрашивание (арбутин) [1, 2].
3. 0.5 гр мелкоизмельченного растительного сырья заливают 5 мл этилового спирта и экстрагируют при периодическом встряхивании и слабом нагревании на водяной бане в течение 1 часа [1, 14].
Полученное извлечение с помощью капилляра наносят на бумагу (3-4 прикосновения капилляра) и хроматографируют восходящим способом в 5%- ной уксусной кислоте до прохождения фронта растворителя 15-17 см (хроматограмма проходит в течение 1 часа при использовании бумаги FN-3). Хроматограмму вынимают, высушивают, обрабатывают раствором 10%- ной спиртовой щелочи и затем реактивом Паули [14].
Арбутин имеет самое высокое значение R=0.75, отделяется от сопутствующих гликозидов и проявляются в виде ярко-красного пятна. Аналогичные результаты можно получить на пластинке “Силуфол” при хроматографировании в системе хлороформ-этиловый спирт (7:3) с последующей обработкой раствором щелочи и реактивом Паули [14].
Хроматограммы до и после обработки реактивами целесообразно просматривать в УФ свете с целью идентификации сырья по отдельным компонентам [16].
Схема хроматограммы экстракта брусники показана на рисунке 8 [14].
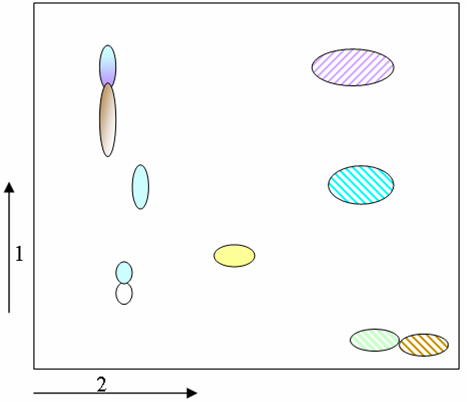
Рисунок 8 - Схема хроматограммы экстракта брусники
1-е направление – 15% уксусная кислота;