Курсовая работа: Микробиологические трансформации стероидов. Методы проведения
Микробиологическое гидроксилирование — это наиболее важный и часто применяемый метод. Наличие гидроксильных групп в 3, 11, 16, 17 положениях молекулы стероида, как правило, обусловливает физиологическую активность большинства гормональных стероидных препаратов.
Гидроксилирование стероидов осуществляется очень многими микроорганизмами, чаще всего грибами, даже конидии некоторых грибов обладают гидроксилирующей активностью. Гидроксилирование стероидов при помощи гриба Rh. Nigricans— яркий пример сочетания, специфичности и разнообразия действия микроорганизмов.
11![]() -Гидроксилирование как один из важнейших путей получения кортизона изучено наиболее детально и давно применяется в промышленности, выходы продуктов трансформации очень высоки. Многие микроорганизмы образуют смесь 11
-Гидроксилирование как один из важнейших путей получения кортизона изучено наиболее детально и давно применяется в промышленности, выходы продуктов трансформации очень высоки. Многие микроорганизмы образуют смесь 11![]() - и 11
- и 11![]() -эпимеров, соотношение которых существенно зависит от фазы развития культуры.
-эпимеров, соотношение которых существенно зависит от фазы развития культуры.
Наличие в молекуле стероидов 11![]() -гидроксильной группы обусловливает физиологическую активность гидрокортизона (кортизола) и преднизолона. Гидроксилированию подвергаются субстраты самого различного строения — от производных эстрана до сложных молекул стеринов, сапогенинов и т. П. Причина этого — очень широкая субстратная специфичность гидроксилаз, которую демонстрируют многие микроорганизмы. Например, штамм Cunninghamellablakesleeana, который вводит оксигруппу в 11
-гидроксильной группы обусловливает физиологическую активность гидрокортизона (кортизола) и преднизолона. Гидроксилированию подвергаются субстраты самого различного строения — от производных эстрана до сложных молекул стеринов, сапогенинов и т. П. Причина этого — очень широкая субстратная специфичность гидроксилаз, которую демонстрируют многие микроорганизмы. Например, штамм Cunninghamellablakesleeana, который вводит оксигруппу в 11![]() -положение обширного набора стероидов — различных производных эстрана, тестостерона, кортексолона, прогестерона и т. Д.
-положение обширного набора стероидов — различных производных эстрана, тестостерона, кортексолона, прогестерона и т. Д.
Получение 14![]() -гидроксипрогестерона при помощи Bacilluscereusявляется одним из немногих примеров гидроксилирования при помощи бактерий. 15
-гидроксипрогестерона при помощи Bacilluscereusявляется одним из немногих примеров гидроксилирования при помощи бактерий. 15![]() -гидроксилирование осуществляется также многими микроорганизмами, основное место среди которых занимают Fusariumи Penicillium.
-гидроксилирование осуществляется также многими микроорганизмами, основное место среди которых занимают Fusariumи Penicillium.
Главным препятствием, стоящим на пути дальнейшего развития промышленного микробиологического гидроксилирования стероидов, так же как и вообще микробиологических трансформаций этих соединений, является низкая производительность ферментаций, несмотря на высокий процентный выход по субстрату. Это обусловлено, с одной стороны, нерастворимостью стероидных субстратов в воде, с другой — токсичностью растворителей, применяемых при внесении стероида и невозможностью использования высоких концентраций субстрата.
2.2.2 Дегидрогенизация стероидов
Наличие двойных связей коренным образом влияет на физиологическую активность препаратов. Используя эту реакцию, получают такие эффективные препараты, как преднизолон. Чаще всего микроорганизмы дегидрируют положения 1,2 и 4,5, но описано и введение двойной связи в положения 7,8; 8,9; 9,11; 16,17; 17,20. Реакции дегидрогенизации осуществляют бактерии и актиномицеты, особенно часто это микоформы Arthrobacter, Corynebacterium, Nocardia. Широкая субстратная специфичность дегидрогеназ показана на большом экспериментальном материале; она позволяет использовать в качестве субстратов ацетаты стероидов, которые являются полупродуктами во многих технологических схемах получения стероидов. Например, Mycobacteriumglobiforme193, дегидрирующая 1,2-связь в кортизоне, так же эффективно превращает и кортизонацетат в преднизонацетат с выходом 86%. Исследование показало, что для этой культуры характерна максимальная удельная трансформирующая активность в период снижения удельной скорости роста.
Реакция дегидрогенизации позволяет получать преднизолон из кортизона, дианабол из метилтестостерона, преднизолон из гидрокортизона. Продукты 1,2-дегидрирования образуются с высокими выходами — до 86%. Распространенность этой реакции объясняется не только наличием соответствующих дегидрогеназ у большого числа микроорганизмов, но и химическими свойствами данного участка стероидной молекулы, ее нестабильностью, особенно при наличии кетогруппы в 3-м положении и (или) двойной связи 4,5. Этими свойствами стероидной молекулы объясняется и доступность связи 1,2 для микробных оксидоредуктаз. Во многих случаях показана обратимость реакций дегидрогенизации и восстановления.
2.2.3 Микробиологическое восстановление
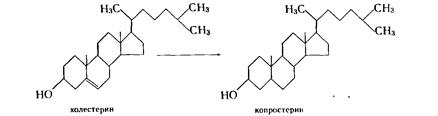
Этот процесс используется в меньшей степени, чем дегидрирование. Он осуществляется главным образом дрожжами и анаэробными бактериями, представителями микрофлоры кишечника млекопитающих, осуществляющими превращение холестерина в копростерин:
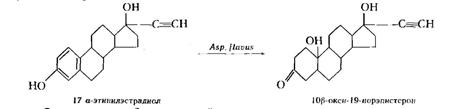
Описаны процессы насыщения двойных связей также и аэробными культурами, широко известными как окислители — актиномицетами, микоформами и даже грибами. Например, культура Aspergillusflavusвосстанавливает ароматическое кольцо некоторых стероидов:
2.2.4 Окисление гидроксильной группы в кетогруппу
Одна из наиболее частых реакций, осуществляемых микроорганизмами (бактериями, актиномицетами, грибами). Наибольший практический интерес представляют окислительные превращения гидроксильных групп у 3, 17 и 20-го атомов стероидной молекулы. Окисление гидроксила в третьем положении легко осуществляется у соединений с ненасыщенным кольцом А, а также при наличии двойной связи в положении 4. К этому же типу окислительных превращений относят введение кетогруппы в молекулу стероида.
2.2.5 Гидролиз эфиров стероидов
Микробиологический гидролиз эфиров стероидов был открыт в 1938 г. Практическая ценность этой реакции определяется тем, что ацилированные стероиды являются обычными промежуточными продуктами химического синтеза, в котором используется ацильная защита функциональных групп. Хотя гидролиз ацильной группы легко осуществим химическим путем, он часто приводит к побочным нежелательным продуктам.
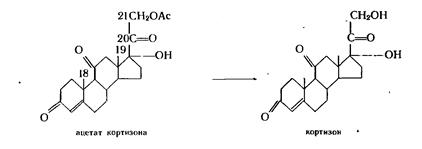
Микробиологическое расщепление эфирной связи осуществляется представителями различных таксономических групп, в частности флавобактериями. Культура Вас. Megateriumобладает специфической активностью по отношению к 21-ацетатам стероидов с диоксиацетоновой цепочкой:
Дезацилирующая способность часто встречается среди микоформ, мукоровых и несовершенных грибов, актиномицетов. Особенность приведенной реакции состоит в том, что она проводится обычно одновременно с другими процессами – гидроксилированием, дегидрогенизацией и др. Ценность представляют как культуры, избирательно отщепляющие ацильную группу, так и микроорганизмы, способные наряду с гидролизом эфирной связи осуществлять еще какую-либо практически важную реакцию.
Культуры, гидролизующие эфирные связи без побочных реакций, обнаружены в разных таксономических группах. Очень интенсивно проводят реакцию дезацетилирования представители видов Actinomucorcorymbosus, Mucorlamprosporus, Actinomycesflavis, A. pheochromogenes, Nocardiasp. и Arthrobactersimplex. Выход реакций достигает 95%. [3]
2.2.6 Отщепление боковых цепей стероидов.
Представляет огромный интерес как путь получения ценных продуктов из относительно дешевых природных стероидов животного и растительного происхождения — стеринов, желчных кислот, сапогенинов.
Возрастающая потребность в производстве стероидных препаратов, а также истощение сырьевой базы делает все более актуальным поиск новых источников сырья. Стоимость диосгенина, получаемого из различных видов диоскореи, за последние годы возросла более чем в 10 раз в результате истощения запасов этих растений. В связи с этим возрос интерес к более доступным природным стеринам.
Основная трудность при использовании фитостеринов заключается в необходимости селективного удаления насыщенной алифатической боковой цепи с сохранением целостности стероидного скелета. Удовлетворительных методов химического расщепления до сих пор не удалось разработать, перспективными считаются лишь микробиологические способы. Однако промышленный интерес представляют только процессы расщепления боковой цепи, не затрагивающие стероидного ядра.
Проблема расщепления боковой цепи стеринов с сохранением стероидного скелета может быть решена следующими способами:
1) синтезом модифицированных стеринов, заместители в кольце А или В которых не позволяют микроорганизмам осуществлять 1,2-дегидрирование или 9![]() -гидроксилирование;
-гидроксилирование;
2) инкубацией стеринов в присутствии соединений, ингибирующих действие ферментов 9![]() -гидроксилазы или 1,2-дегидрогеназы,
-гидроксилазы или 1,2-дегидрогеназы,