Курсовая работа: Молекулярные механизмы многообразия антител
У высших позвоночных существуют пять разных классов антител – IgAIgE, IgG и IgM, каждый со своим классом Н-цепей – a, b, е, g, и m соответственно. Молекулы IgA содержат a-цепи, молекулы IgG-g-цепи. Кроме того, имеется ряд подклассов IgG и некоторых других иммуноглобулинов. Разные Н-цепи придают «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса.
IgG-антитела составляют основной класс иммуноглобулинов, находящийся в крови. Они производятся в больших количествах при вторичномиммунном ответе. Fc-область молекул IgG связывается со специфическими рецепторами фагоцитирующих клеток, таких как макрофаги и полиморфноядерные лейкоциты, и в результате эти клетки могут более эффективно поглощать и разрушать внедрившиеся микроорганизмы, покрытые IgG-антителами (рис. 6).
Молекулы IgG-единственные антитела, которые могут переходить от матери к плоду. Клетки плаценты, соприкасающиеся с материнской кровью, имеют рецепторы, связывающие Fc-области молекул IgG и обеспечивающие тем самым их переход в плод. Антитела сначала поглощаются путем эндоци-тоза при участии рецепторов, а затем транспортируются через клетку и выводятся путем экзоцитоза в кровь плода. Антитела других классов не связываются с этими рецепторами и поэтому не могут проходить через плаценту.
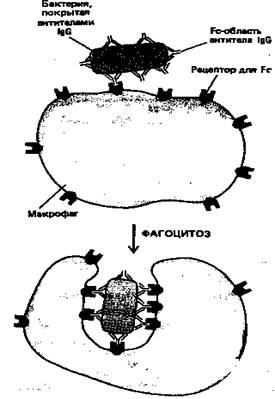
Рисунок 6. Эта схема показывает, как бактерия, покрытая антителами IgG , эффективно фагоцитируется макрофагами, имеющими на своей поверхности рецепторы, способные связывать Fc -область молекулы IgG . Связывание бактерии с этими рецепторами активирует процесс фагоцитоза.
Хотя IgG-явно преобладающий класс антител, образуемых при большинстве вторичных иммунных ответов, на ранних стадиях первичного иммунного ответа в кровь поступают главным образом антитела IgM. В секретируемой форме IgM представляет собой пентамер, состоящий из пяти четырехцепочечных единиц, так что в общей сложности IgM имеет 10 антиген-связывающих участков. Такие пентамеры даже более эффективно, чем IgG, активируют систему комплемента, когда они связываются с антигеном. Каждый пентамер содержит полипептидную цепь еще одного типа, называемую J-цепью (joiningchain, ~ 20 000 дальтон). J-цепь синтезируется IgM-секретирующими клетками, ковалентно встраивается между двумя смежными Fc-областями и, по-видимому, инициирует процесс олигомеризации. IgM-это также первый класс антител, продуцируемых развивающимися В-клетками, хотя многие В-клетки со временем переключаются на выработку антител других классов. Непосредственные предшественники В-клеток, так называемые пре-В-клетки, вырабатывают μ-цепи (но не легкие цепи) и накапливают их. Позднее, когда в пре-В-клетках начинают синтезироваться и легкие цепи, они соединяются с j-цепями, образуя с ними четырехцепочечные молекулы IgM (каждая с двумя μ-цепями и двумя легкими цепями), которые встраиваются в плазматическую мембрану, где служат рецепторами для антигена. С этого момента клетки становятся В-лимфоцитами и способны реагировать на антиген. Хотя встраиваться в мембраны (в качестве антиген-специфических рецепторов) и секретироваться в водорастворимой форме могут антитела всех классов, на поверхности большинства покоящихся В-клеток находятся главным образом антитела IgM и IgD. Удивительно, что лишь очень немногие В-клетки активируются для секреции антител IgD, и у этого класса не известно никакой функции, кроме роли рецепторов для антигена.
IgA-основной класс антител в секретах (молоке, слюне, слезах, секретах дыхательных путей и кишечного тракта). Они существуют либо в виде четы-рехцепочечного мономера (подобно IgG), либо в виде димера. Молекулы IgA в составе секретов представляют собой димеры, содержащие одну J-цепь, а также дополнительную полипептидную цепь, называемую секреторным компонентом, которую димеры IgA приобретают на поверхности эпителиальных клеток, выстилающих кишечник, бронхи или протоки молочных, слюнных или слезных желез. Секреторный компонент синтезируется эпителиальными клетками и экспонируется вначале на их базальной поверхности, где служит рецептором для связывания IgA из крови. Образующиеся комплексы IgA с секреторным компонентом поглощаются путем эндоцитоза при участии рецепторов, проходят через цитоплазму эпителиальной клетки и выводятся в проток на противоположной стороне клетки. В дополнение к такой транспортной роли секреторный компонент, возможно, защищает молекулы IgA от переваривания протеолитическими ферментами секретов.
Fc-область молекул IgE связывается со специфическими рецепторными белками на поверхности тучных клеток в тканях и базофильных лейкоцитов в крови с очень высоким сродством (> 1010 литров/моль). В свою очередь связанные молекулы IgE служат рецепторами для антигена: присоединение к ним антигена приводит к секреции клетками биологически активных аминов (в частности, гистамина, а у некоторых видов – серотонина). Их защитная функция менее ясна, однако предполагается, что они делают область воспаления более доступной для лейкоцитов, антител и компонентов комплемента.
1.3 Тонкая структура антител
Уникальная особенность антител состоит в том, что они существуют в огромном числе различных вариантов: каждый класс иммуноглобулинов содержит миллионы разных антител, каждое из которых отличается от других своим антигенсвязывающим участком и аминокислотной последовательностью. Поэтому любой из таких видов антител составляет менее одной миллионной доли всех молекул иммуноглобулинов, имеющихся в крови. Этот факт поставил иммунохимиков перед чрезвычайно сложной проблемой белковой химии: каким образом можно получить достаточное количество какого-либо антитела для определения его аминокислотной последовательности и трехмерной структуры?
Проблема получения индивидуальных антител была решена благодаря специфическому свойству опухолевых клеток, образующихся при множественной миеломе – злокачественном заболевании, при котором в костном мозге развиваются множественные опухоли. Эти опухоли секретируют в кровь большие количества антител одного вида. Такие антитела гомогенны, или моноклональны, поскольку рак обычно начинается с неконтролируемого роста одной-единственной клетки; в данном случае это плазматическая клетка, секретирующая антитела. Антитело, накапливающееся в крови, называют миеломным белком.
Еще с прошлого столетия было известно, что моча больных, страдающих этим заболеванием, часто содержит необычные белки, названные белками Бене-Джонса– по имени английского врача, который их впервые описал. Однако только в 50-х годах нашего века выяснилось, что эти белки представляют собой свободные L-цепи иммуноглобулинов. Значительная часть сведений о детальной структуре антител была получена при изучении миеломных белков из мочи или крови больных или же белков от мышей, у которых были целенаправленно индуцированы аналогичные формы рака.
При сравнении аминокислотных последовательностей множества различных миеломных белков выявилась поразительная особенность, имеющая важный и неожиданный генетический подтекст. N-концевая часть последовательно как L-, так и Н-цепей чрезвычайно изменчива, а С-концевая - постоянна, пример, если сравнить аминокислотные последовательности большого числаразличных миеломных х-цепей (каждая длиной около 220 аминокислот) окажется, что С-концевые половины у них одинаковы или различаются незначительно, тогда как N-концевые половины все разные. Таким образом, L-цепи содержат константную областьпримерно из 110 аминокислот и вариабельную областьтакой же длины. N-концевая вариабельная область Н-цепи тоже состоит приблизительно из 110 аминокислот, а константная, в зависимости от класса антител, - из 330 или 440 аминокислот.
Именно N-концевые части L- и Н-цепей совместно образуют ант связывающий участок, и вариабельность их аминокислотных последователь- ностей обеспечивает структурную основу для разнообразия таких участков. В связи с существованием вариабельной и константной областей в молекулах антител возникают важные генетические проблемы. Но еще до того как стало возможным прямое изучение этих вопросов, в результате исследования миеломных белков выяснились другие черты структуры антител.
Каждая L- и Н-цепь содержит по три гипервариабельных области, которые совместно формируют антиген‑связывающий участок
Только часть вариабельной области непосредственно участвует в связывании антигена. Этот вывод вначале был сделан в результате оценки максимальных размеров антиген-связывающего участка. Первые измерения, в которых «молекулярными линейками» служили олигомеры разной величины, были проведены с использованием антител к декстрану - полимеру D-глюкозы. Так как для ингибирования связывания декстрана с антителами к нему применены сахариды, трисахариды и олигосахариды большей длины, состоящие остатков глюкозы, их действие возрастало с увеличением длины цепи примерно до шести мономеров; с олигосахаридами большей длины эффект не увеличивался. Это позволяло предполагать, что наиболее крупные антиген-связывающие участки могут контактировать самое большее с пятью или шестью сахарными остатками антигена. Поэтому казалось крайне маловероятным, что все 220 аминокислот вариабельных областей L- и Н-цепей вносят непосредственный вклад в построение антиген-связывающего участка. И действительно, теперь ясно, что связывающий участок антитела формируют всего лишь около 20-30 аминокислотных остатков вариабельной области каждой из цепей. Первым свидетельством в пользу этого явились данные об аминокислотных последовательностях, которые показали, что различия между вариабельными областями как в L-, так и в Н-цепях в основном ограничены тремя небольшими гипервариабельными областями в каждой цепи. Остальные части, известные под названием структурных областей, относительно константны. Эти данные позволяли предсказать, что антиген-связывающий участок образуют всего лишь 5-10 аминокислот каждой гипервариабельной области. Это предсказание было впоследствии подтверждено рентгеноструктурным анализом антител.
2. Молекулярные механизмы многообразия антител
После ознакомления с тем фактом, что громаднейшее разнообразие антител является необходимым условием правильного функционирования защитной системы организма, рассмотрим обеспечивающие это условие механизмы.
Каждая L- и Н-цепь кодируется более чем одним генным сегментом
Участие необычных генетических механизмов в образовании антител стало очевидным задолго до того, как стало ясно, какой вклад вносят эти механизмы в разнообразие антиген-связывающих участков. Как уже говорилось изучение аминокислотных последовательностей миеломных белков показало, что каждая цепь иммуноглобулина состоит из вариабельной (V) и константной (С) областей, и тогда возник вопрос: как такие цепи кодируются в геноме? Уже в то время предполагали, что V- и С-области каждой из цепей могут кодироваться двумя отдельными генами, которые каким-то образом соединяются перед экспрессией.
Первые прямые данные о перестройке ДНК в процессе развития В-клеток были получены в 1976 г. в экспериментах, в которых ДНК из ранних мышиных эмбрионов, неспособных к выработке антител, сравнивали с ДНК из клеток мышиной миеломы, вырабатывающих антитела. Эти два вида ДНК переваривали рестрикционной нуклеазой и полученные фрагменты гибридизо-вали с радиоактивными последовательностями ДНК, приготовленными путем копирования invitroV- или С-последовательности молекул информационной РНК для L-цепей, выделенной из клеток миеломы. Как показали результаты этих опытов, специфические V- и С-кодирующие последовательности находились у эмбрионов в разных рестрикционных фрагментах ДНК, а в клетках миеломы – в одном и том же рестрикционном фрагменте. Таким образом, у зародыша, где гены иммуноглобулинов не экспрессируются, последовательности ДНК, кодирующие V- и С-области той или иной цепи, локализуются в различных участках генома; между тем в клетке миеломы, где уже образуются цепи иммуноглобулинов, эти две последовательности соединены вместе.
Сейчас известно, что для каждого типа цепей иммуноглобулинов –легких цепей х, легких цепей λ и тяжелых цепей – существует отдельный «пул» (обширная группа) генов, которые могут быть использованы при синтезе каждой отдельной полипептидной цепи. Каждый такой пул содержит набор различных V-генов, расположенных на сотни тысяч нуклеотидов «выше» (т.е. ближе к 5'-концу кодирующей цепи ДНК) одного или нескольких С- генов. В процессе развития В-клеток любой из V-геновможет быть транслоцирован таким образом, что он окажется рядом с определенным С-геном. Тогда, после того как произойдет такая перестройка ДНК, может синтезироваться цепь иммуноглобулина.
Пулы генов, кодирующие х-, λ- и Н-цепи, находятся в разных хромосомах. У мыши пул генов х в хромосоме 6 содержит один С-ген (Сх ) и большой набор V-генов (Vx l, VX 2, VX 3...). Пул генов λ, в хромосоме 16 содержит только два V-гена (Vλ l и Vλ 2), каждый из которых ассоциирован с одним или двумя разными С-генами С λ . Пул тяжелых цепей, находящийся в хромосоме 12, содержит большой набор V-генов (Vh) и упорядоченную группу различных С-генов, каждый из которых кодирует отдельный класс тяжелых цепей (Сα, Сβ ,Сε и Сλ ) (рис. 17-40). В случае тяжелой цепи первоначальная транслокация Vн -гена всегда переносит его близко к Сμ-гену, поэтому первым антителом, синтезируемым развивающейся В-клеткой, всегда оказывается молекула IgM.
На самом деле эти пулы генов сложнее, чем показано на рис. 17-40. Вместо того чтобы кодироваться одним-единственным V-геном, как предполагалось вначале, каждая V-область полипептидной цепи кодируется двумя или тремя отдельными генными сегментами,которые объединяются в функциональный V-ген только тогда, когда происходит перестройка ДНК, соединяющая вместе V- и С-кодирующие области. Как мы увидим, такое объединение различных V-сегментов, приводящее к образованию гена V-области, непосредственно увеличивает разнообразие антиген-связывающих участков.
V-область каждой L-цепи кодируется двумя генными сегментами
То, что V-области кодируются более чем одним генным сегментом, установлено в 1978 г., когда был закончен первый анализ нуклеотидной последовательности одного из генов иммуноглобулиновгена Vλ , выделенного из эмбриона мыши. Вместо того чтобы кодировать все 110 аминокислот Vλ -области, ген Vλ кодировал только 97 N-концевых аминокислот. Оказалось, что оставшиеся 13 аминокислот этой области кодируются отдельным сегментом ДНК, расположенным на сотни тысяч нуклеотидов дальше и получившим название соединительного или Jλ -сегмента (не путать с боковой J-цепью, которая кодируется в другой части генома). Jλ -сегмент всегда примыкает к Сλ ,-гену, от которого он отделен интроном. В ходе развития В-клетки Vλ -ген (который мы будем далее называть Vλ -сегментом), поскольку он кодирует лишь часть Vλ -области полипептидной цепи, транслоцируется таким образом, что оказывается рядом с Jλ -сегментом, так что в ДНК получается последовательность Vλ -Jλ -интрон-Сλ . Эта последовательность транскрибируется в молекулы РНК, из которых интроны после удаляются, так что после сплайсинга образуются молекулы мРНК с примыкающими друг к другу последовательностями V, J и С. Именно эти молекулы мРНК транслируются в полипептиды легких цепей.
Впоследствии было установлено, что у мышей имеется несколько разных J-сегментов в каждом пуле генов для иммуноглобулинов: по одному ассоциировано с каждым С-геном в генном пуле λ-цепей и по четыре – в генных пулах х- и Н-цепей (каждый С-ген отделен от соседнего с ним J-сегмента интроном). В период развития В-клеток в генных пулах х- и Н-цепей любой V-сегмент может объединиться с любым J-сегментом, что увеличивает в четыре раза число V-областей, которые эти пулы могут производить. Кроме того, существуют некоторые различия в точном месте соединения V-J, и это приводит к еще большему разнообразию аминокислотных последовательностей. Существенно то, что сайт соединения V-J кодирует часть третьей гипервариабельной области легкой цепи.
После соединения V и J все «лишние» J-сегменты «ниже» присоединенного J-сегмента транскрибируются, а затем их последовательности, так же как и последовательности интронов, вырезаются из РНК-транскрипта (рис. 6). Появляется все больше данных в пользу того, что соединение тех или иных V- и J-сегментов ДНК в процессе развития В-лимфоцитов сопровождается элиминацией всей лежащей между ними ДНК (см. рис. 6). Конкретный механизм соединения сегментов, которые могут быть удалены друг от друга на сотни тысяч нуклеотидов, остается загадкой. Однако обнаружены специфические, весьма консервативные последовательности ДНК, примыкающие «снизу» к V-сегментам и «сверху» к J-сегментам.
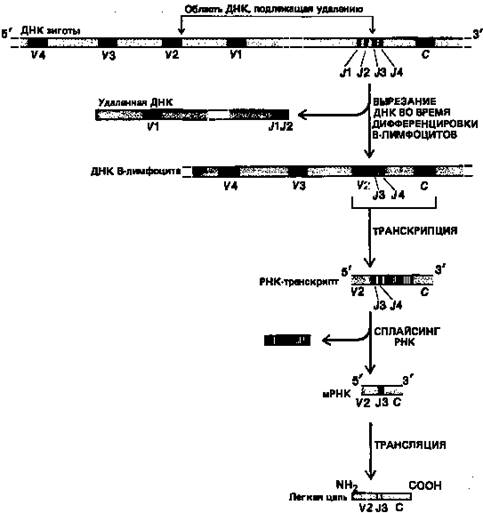
Рисунок 6. Процесс соединения V - J , с которым связано образование х-легкой цепи у мыши.
Предполагается, что они могут служить сайтами узнавания для ферментов сайт-специфической комбинации ДНК (рис. 7), но такого рода ферменты пока не идентифированы.
V -область каждой Н-цепи кодируют три генных сегмента