Курсовая работа: Мукозный иммунитет
В слизистых оболочках разных органов содержится значительное количество лимфоидных клеток, которые локализуются в соединительной ткани собственной пластинки (Laminapropria) и в эпителиальном слое.
В собственной пластинке кишечника находятся Т - и В-лимфоциты, НК-клетки, ДК, макрофаги, эозинофилы. Встречаются также тканевые базофилы, которых особенно много в подслизистом слое. Доминируют в клеточном составе лимфоидные клетки, среди которых Т-лимфоциты численно преобладают над В-лимфоцитами. Т-Клетки (40 - 60% клеточного состава) по фенотипическим признакам (частотой экспрессии рецепторов αβ и γδ-типа и маркеров CD4 iCD8) почти не отличаются от Т-лимфоцитов периферической крови и составляют часть рециркулирующего пула. Большинство Т-клеток экспрессируют рецептор αβ-типа (более 90%) и только незначительная часть (<10%) - рецептор γδ-типа. Количество CD4Т-клеток (60%) значительно превышает количество CD8Т-клеток (25-30%). Доля В-лимфоцитов также значительна: может достигать 20-40% клеточного состава. Характерно, что, начиная с двухлетнего возраста, у человека в собственной пластинке концентрируются В-лимфоциты и плазматические клетки, которые экспрессируют преимущественно IgA (около 80% общего количества антителпродуцентов). Возможно, это связано со стимулирующим влиянием микрофлоры, которая заселяет слизистые оболочки, поскольку у безмикробных животных такая избирательность не наблюдается. Характерная особенность популяции В-лимфоцитов Laminapropria количественное преобладание в ее составе CD5+ В1-клеток над CD5- В-клетками. В1-клетки синтезируют преимущественно низкоафинные антитела IgМ и IgА.
В пределах эпителиального слоя лимфоциты локализуются между эпителиальными клетками (ближе к базальной мембране), их называют внутриэпителиальными лимфоцитами (ВЭЛ). ВЭЛ представлены почти исключительно Т-лимфоцитами (ВЭЛ-Т), 80-90% ВЭЛ экспрессируют маркер CD3. большинство ВЭЛ-Т несут на поверхности полипептид НМL-1, который является представителем семейства α-цепей интегринов. Соединяясь с β7-цепью, он образует интегрин α НМL-1 - β7. экспрессия этого антигена свидетельствует о том, что ВЭЛ-Т в активированном состоянии. Известно, что Т-клетки периферической крови в состоянии покоя не имеют этого антигена, однако экспрессия его индуцируется после их активации ФГА.
ВЭЛ-Т отличаются от Т-клеток собственной пластинки (и периферической крови) преобладанием CD8-клеток (75%) над CD4-клетками (7%) и большей частью Тγδ.
У человека Тγδ составляют 10-40% ВЭЛ-Т. У мышей на момент рождения часть Тγδ достигает 80%, а у взрослых 30% ВЭЛ-Т, т.е. количество их неодинаково для разных отделов кишечника и зависит от возраста, линий мышей, условий. Большинство Тγδ в отличии от Тαβ не несут субпопуляционных маркеров, часть (около 30%) экспрессируют молекулу CD8, но в виде αα-димера, а не αβ-димера, как CD8Т αβ. Считают, что часть Тγδ дифференцируется в кишечнике, при этом большая их часть экспрессирует рецептор Vγ5δ4, другие - рецептор Vγ5δ1 [4,5].
Большинство Т-лимфоцитов, которые локализуются в эпителиальном слое и собственной пластинке слизистых оболочек, несут молекулу CD45R0 - маркер клеток памяти, что является признаком того, что они уже встречались с антигеном и, значит, не являются наивными.
Кроме лимфоидных клеток в слизистых оболочках содержатся также клетки нелимфоидной природы, которые принимают участие в иммунных реакциях - выполняют роль АПК. Это дендритные и собственно эпителиальные клетки. Способность презентовать антиген для Т-лимфоцитов они приобретают после активизации в очаге воспаления под влиянием цитокинов.
Эти два типа клеток отличаются по особенностям презентации антигена Т-лимфоцитам и их стимуляции. ДК представляют антиген в комплексе с классическими молекулами МНС, эпителиальные клетки - с классическими МНС, так и неклассическими молекулами - CD1d. У ДК роль костимулятора во время активизации Т-клеток выполняет молекула CD80, в эпителиальных клетках, которые не экспрессируют CD80, - вероятно ассоциированный с CD1d гликопротеин qp180, который распознает на Т-клетке молекулу CD8. Важность этого пути презентации антигена и активации Т-клетки состоит в том, что молекулы CD1d могут представлять не только белковые, но и липидные и гликолипидные антигены. Последние, как известно. Входят в большом количестве в состав клеточной стенки бактерий, роль которых, как причинных факторов кишечных инфекций довольно значительна.
Лимфоидные клетки слизистых оболочек, как розсеяные, так и локализованные в лимфоидных образованиях, обеспечивают создание местного иммунитета. Внутриэпителиальные лимфоциты, большинство которых несет субпопуляционный маркер Т-лимфоцитов - молекулуCD8, выполняют функцию иммунного надсмотра за эпителием, который быстро пролиферирует, элиминируя мутантные, инфицированные вирусами и некоторыми бактериями, а также измененные под влиянием токсических или других факторов клетки. Цитотоксическую активность определяют как Тαβ-, так и Тγδ-клетки с маркером CD8. CD8-клетки обоих типов содержат на поверхности особый белок BV55, который характерен для всех лимфоцитов с цитотоксическими функциями, включая НК-клетки. При этом первыми на инвазию инфекционных агентов реагируют Тγδ, которые рассматриваются как "часовые" эпителиальных тканей. Распознавая определенные консервативные структуры микробных клеток (в комплексе с белками теплового шока, которые продуцируются клетками под влиянием стрессовых факторов), Тγδ активизируются, продуцируют цитокинины (ИНФ-γ, ФНП-α) и приобретают способность разрушать как собственно патогенны, так и инфицированные ними, а также те, которые подверглись стрессу (и как результат этого - функционально неполноценные), эпителиальные клетки. Объектом распознавания Тγδ также могут быть МНС I-подобные белки MICA и MICB, которые экспрессируются энтероцитами кишечника во время стресса и эпителиальными опухолевыми клетками (у людей и разных видов животных, но не мышей). Получено интересные данные, что Тγδ способны также стимулировать рост эпителиальных клеток (путем продуцирования цитокинов) и способствовать восстановлению однородного пласта "продырявленной" ими самими эпителиальной выстилки [2].
Активированные Тγδ вместе с другими клетками природного иммунитета - гранулоцитами. Моноцитами (которые задействуются при помощи цитокинов) первыми вступают в борьбу с патогенами, которые проникают сквозь слизистые оболочки. Спустя некоторое время к защите присоединяются антигенспецифические Тαβ с цитотоксической и хелперной функциями и В-лимфоциты, которые развивают гуморальный иммунный ответ - продуцируют антитела IgA (Рис.6). Слизистые оболочки основное место синтеза антител этого класса.

Рис.6. Димер IgA [1]
1-J-цепь, 2-секреторный компонент
Развитию IgA-ответа в слизистых оболочках способствуют условия микроокружения. Секретированные локализованными в Laminapropriaплазматическими клетками IgAтранспортируется на поверхность слизистых оболочек, где реализует защитные функции.
Секреторные sIgAзащищают слизистые оболочки от патогенов, блокируя сайты связывания их с эпителиальными клетками. Таким образом sIgA выполняют роль первой линии специфической защиты на пути проникновения патогенных микроорганизмов и имеют большое значение для обеспечения невосприимчивости организма к инфекциям, которые ассоциированы со слизистыми оболочками. Дефицит антител этого класса - самая распространенная форма иммунодефицита у европеоидов (1: 700 человек) - обуславливает понижение резистентности к инфекционным агентам, в частности гноеобразующих микроорганизмов, особенно в тех случаях, когда он присоединяется к дефициту определенных субклассов IgG. В защите слизистых, вероятно, могут принимать участия и антитела класса М, поскольку соединенная I-цепью пентамерная молекула IgМ также может выноситься на поверхность эпителия.
Локализованные в слизистых оболочках, в том числе и в перовых бляшках, дендритные и Т-хелперные клетки также принимают участие в индуцировании иммунной толерантности к антигенам, которые попадают peros [2,5].
2. Механизмы, регулирующие образование в слизистых оболочках плазматических клеток, которые продуцируют IgA
Преобразование В-лимфоцитов в плазматические клетки, которые выделяют IgA, сложный многоэтапный процесс, зависимый от участия Т-лимфоцитов и других клеток, а также от продуцированных ними цитокинов. Эта регуляция касается прежде всего двух этапов на пути преобразования В-лимфоцитов: процесса переключения классов (switching) IgM → IgA, а также процесса остаточной дифференциации В-лимфоцитов в клетке, продуцирующей антитела.
2.1 Регуляция процесса переключения классов
Процесс переключения классов происходит в перовых бляшках, главным образом в куполах, при участии дендритных клеток и Тh-лимфоцитов. Кажется, что ключевую роль в этом процессе относительно синтеза IgA играет цитокинин TGF-β. Переключение классов Ig может быть одноэтапным (IgМ→ IgA), или - реже - двухэтапным (IgМ → IgG, IgG → IgA).
В лимфатических фолликулах перовых бляшек можно выделить две субпопуляции В-лимфоцитов IgA+ : малые В-лимфоциты памяти в состоянии покоя со слабой экспрессией рецептора для агглютинина земляных орехов (peanutagglutinin - PNA) и с сильной экспрессией цепи к, а большие лимфобласты в состоянии деления с сильной экспрессией рецептора для PNA и слабой для цепи к. Первые являются непосредственными предшественниками плазматических клеток, которые находят в слизистых оболочках. Роль другого вида клеток изучается. Процесс активации и переключения классов (IgМ → IgA), вероятно, зависит также от вида антигена. Такое свойство имеет LPS.
2.2 Регуляция пролиферации и дифференциации В-лимфоцитов
Образованные в вышеупомянутых процессах лимфоциты В IgA+ , "направленные" (commited) на продукцию антител IgA, подлежат регуляторным влияниям, что приводит к их окончательной дифференциации и продуцирования ними IgA. Из многих исследований выходит, что эти процессы зависимы от Тh цитокинов, прежде всего IL-5 иIL-6. отдельные данные наводят на мысль, что на дифференцировку позитивно влияет также IFN-γ. Посредственное влияние, которое усиливает выделение IgA, придает также IL-1. лимфоциты IgA+ в перовых бляшках преобладают над другими популяциями В-лимфоцитов - их процент в центрах размножения бляшек Пеера равняется 60-70%.
Регуляция дифференцирования лимфоцитов В IgA+ , правдоподобно, является зависимой также от клеток, которые имеют рецепторы для фрагмента FcIgA (FcaR), особенно Т-лимфоцитов. Часть этих клеток ответственны за суппресию продукции IgA на периферии, например Т-лимфоциты FcaR+ СD8, изолированы с селезенки. Подтверждено. Что этот процесс происходит при участии освобожденного этими лимфоцитами так называемого фактора, который связывает IgA (IgAbindingfactor- IgA-BF). Другие по очереди лимфоциты ТссаR+ (фенотипаТh), изолированные в бляшках Пеера, преимущественно усиливали гуморальный ответ IgA. Принято, что местная концентрация IgA, как и отношение В-лимфоцитов к Т-лимфоцитам, может существенно моделировать освобождение факторов, которые тормозят или стимулируют IgA, что на основе обратной связи регулировало бы иммунный ответ в пределах этих антител. Определенную роль в регуляции образования IgA в слизистых оболочках играют контрсуппресивные лимфоциты [2,5].
3. Иммунный ответ в слизистых оболочках
Элиминация патогенных микроорганизмов, которые поступают в слизистые оболочки, обеспечивается преимущественно развитием гуморального иммунного ответа с продуцированием секреторных IgA. В перовых бляшках и других фолликулярных структурах, куда попадает антиген с поверхности эпителия, происходит праймирование нитивных Т - и В-лимфоцитов, активация, пролиферация и детерминация путей следующего их дифференцирования. Продуцированные клетками микроокружения цитокины направляют дифференциацию CD4 Т-клеток в Тх2 и Тх3 и переключение синтеза иммуноглобулинов В-лимфоцитами с IgМ-изотипа на IgA-изотип. Переключение изотипа антител, вероятно, индуцирует ТФР-β, которое продуцируется Тх3. Так иногда называют субпопуляцию Т-хелперов, которые локализуются в слизистых оболочках, продуцируют кроме ТФР-β также IL-4 bIL-10 и важные для стимуляции образования IgA-антител В-лимфоцитами слизистых.
Праймированные Т - и В-лимфоциты выходят с перовой бляшки, входят через афферентный лимфатический сосуд в региональный мезентериальный лимфоузел, откуда через грудной проток попадают в кровяное русло, а с кровью в селезенку, где задерживаются на несколько суток (на протяжении которых происходит их дифференцирование), после чего они опять возвращаются в слизистую оболочку (Рис.7) [4].
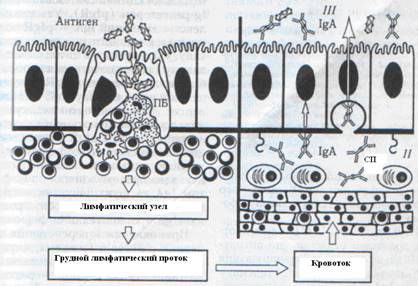
Рис.7. Развитие иммунного ответа в слизистых оболочках:
ПБ - пеерова бляшка; СП - собственная пластинка слизистой оболочки; I- индуктивная, II- продуктивная, III- эффекторная фаза иммунного ответа.
Кроме клеточного и гуморального иммунного ответов, слизистые оболочки способны к анти-HIV-активности благодаря выделяемым веществам, например некоторым белкам слюны, обладающим ингибиторной активностью в отношении ВИЧ (Табл.1) [1].
Таблица 1. Белки слюны, обладающие ингибиторной активностью по отношению к ВИЧ
| Компоненты слюны | Тип фактора | Механизм ингибирования ВИЧ |
| SLP (secretory leukocyte protease inhibitor) | Ингибирование сериновой протеазы | Взаимодействует с хемокиновыми рецепторами клетки и (или) блокирует стадию раздевания вируса |
| Муцины | Гликопротеины | Способствует агрегации вируса, уменьшая его титр, нарушает взаимодействие gp120 и gp41 |
| Пролинбогатые белки | Пролинбогатые белки | Предотвращается взаимодействие вируса с клеткой |
| Лактоферин | Fe-связывающие гликопротеины | Связывается с V3-петлей gp120 |