Курсовая работа: Новые современные коагулянты в технологии очистки сточных вод
На рисунке 2 представлены данные по растворимости гидроксидов алюминия и железа в зависимости от рН [8].
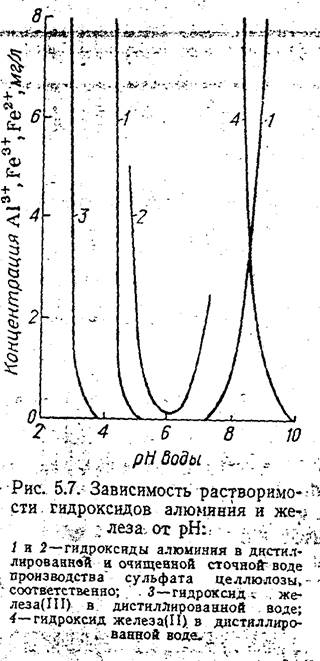
Из рисунка 1 видно растворимость А1 (ОН)3 в сточной воде выше чем в дистиллированной. Растворимость гидроксида алюминия резко возрастает в пределах 4,5 > рН > 8.
С увеличением температуры растворимость гидроксида алюминия снижается. Зависимость растворимости гидроксида алюминия в воде от температуры при различных рН на рисунке 2.
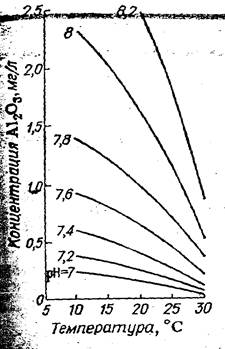
Рис. 2 Зависимость растворимости Гидроксида алюминия от температуры при различных рН
Для быстрого и полного протекания процесса гидролиза не обходим некоторый щелочной резерв воды для связывания ионов водорода выделяющих при гидролизе этим щелочным резервом могут быть бикарбонат – ионы, 3 присутствующие в воде, или специально введенные щелочные реагенты – известковое молоко, кальцинированная или каустическая сода [3,16].
В результате применения сульфата алюминия увеличивается степень сточной воды.
Очень перспективным коагулянтом является оксихлорид алюминия А12 (ОН)5 С1. В Японии этот коагулянт применяется с 1966 г. Он получается из гидроксида алюминия и соляной кислоты. Основные преимущества оксихлорида алюминия, по сравнению с глиноземом – большое содержание алюминия в продукте, меньшее снижение щелочности воды и меньшее повышение ее солесодержания. Оксихлорид имеет более сильное коагуляционное действие и большую скорость хлопьеобразования Хорошо растворяется в воде.
Для рекуперации белковых веществ из сточных вод рекомендуется использовать в качестве коагулянта лигносульфонат алюминия, получаемый из лигносульфоната натрия или путем ионообменной реакции.
В качестве коагулянтов могут быть применены алюмокалиевые квасцы [А1К(SО4 )2 *12NаОH] или алюмоаммонийные квасцы [А1 (NН4 ) (S04 )2 *12Н2 O], имеющие меньшую стоимость и менее дефицитные, чем глинозем. Следует отметить, что при использовании алюмоаммонийных квасцов и наличии в очищаемой воде свободного хлора наблюдалось образование токсичных хлораминов.
Дешевыми коагулянтом является хлорид алюминия, который получают на нефтехимических комбинатах термическим гидролизом каталитического комплекса отработанного хлорида алюминия, применяемого в процессах изомеризации и при производстве этилбензола. Показана возможность использования этого коагулянта для очистки сточных вод производства синтетического спирта.
Известен коагулянт на основе алюминия, так называемый гидрокарбоалюминат кальция в виде однородного порошка серо-белого цвета. Гидрокарбоалюминат кальция получают как попутный продукт производства глинозема способом гидрохимического синтеза кальция из щелочно-карбоалюминатных растворов и извести при комплексной переработке нефелинов. Недостатками этого коагулянта – гидрокарбоалюмината кальция – являются высокая его стоимость и дефицитность, поскольку для его получения в качестве минерала используют нефелин, более редко встречающийся в природе, чем, например, бокситы, что и сказывается на его высокой стоимости.
2.2 Соли железа
Сульфат железа (11) или железный купорос FeSO4 *7Н2 О. Железный купорос представляет собой прозрачные кристаллы зеленого цвета. Под действием кислорода воздуха двухвалентное железо окисляется в трехвалентное приобретают бурый оттенок. В воде растворяется 265 г./л железного купороса при 20°С.
Растворимость гидроксида железа (II) в воде приведена на рис. 1, из которого видно, что этот коагулянт может применяться при рН > 9–10. Для уменьшения концентрации растворенного гидроксида железа (II) при более низких величинах рН производят окисление двухвалентного железа в трехвалентное. Процесс окисления осуществлять за счет растворенного в воде кислорода: 4FeSO4 + O2 + 2H2 O = 4Fe(OH)3 .
Для окисления железа может быть использован метод хлорирования. Расход хлора при составляет 0,24 мг на 1 мг FeSO4 .
Положительное качество солей железа как коагулянтов – высокая плотность гидроксида (3,6 г/см3 ), обеспечивающая получение плотных, тяжелых хлопьев оседающих с большой скоростью.
Коагуляция с использованием солей железа неприемлема для сточных вод, содержащих фенолы, так как образующиеся растворимые в воде феноляты железа интенсивно окрашены. Кроме того, гидроксид – железа является катализатором, способствующим окислению некоторых органических веществ и образующим комплексные окрашенные соединения, растворимые в воде.
Хлорид железа (III). FeCI3 * 6Н2 O представляет собой темные кристаллы с металлическим блеском, очень гигроскопичен.
С целью повышения эффективности очистки сточных вод предложено использовать коагулянт, состоящий из смеси растворов сульфата алюминия и хлорида железа в соотношении 1: 1 (по массе). Преимущества смешанного коагулянта повышение эффективности очистки воды при низких температурах и улучшение седиментационных свойств хлопьев.
Однако трудности, связанные с хранением и приготовлением коагулянта, а также возможность повышения содержания железа в очищенной воде при нарушениях технологического процесса, ограничивает применение смешанного коагулянта.
2.3 Соли магния
Хлорид магния предложено использовать для очистки сточных вод производства полистирольных пластмасс, а также вод, загрязненных эмульгированными маслами. Очистка производится при рН = 11,0. Растворимость гидроксида магния в воде при 200 С – 9 мг/л – плотность – 2,4 г/см3 . С. Уменьшением величины рН растворимость гидроксида магния в воде увеличивается.
Использование солей магния позволяет сократить продолжительность хлопьеобразования. Снижение температуры очищаемой воды практически не уменьшает эффективности ее очистки. В качестве коагулянтов могут быть использованы сульфат магния (МgSO4 *7Н2 О) и хлорид магния (МgС12 * 6Н2 О).
Для очистки сточных вод может быть использован известковый шлам с добавлением карбоната магния. При этом происходит осаждёние Мg(ОН)2 и СаСО3 . Преимущества этого метода: вода в процессе очистки практически не загрязняется минеральными солями, имеется возможность регенерации Мg из осадка путем обработки его диоксидом углерода образованием растворимого в воде бикарбоната магния который может быть повторно использован[5].
3. Современные новые коагулянты, способы их получения и применения
3.1 Алюмосиликатный раствор