Курсовая работа: Определение эквивалентной электропроводности уксусной кислоты при бесконечном разбавлении графич
Удельная и молярная электрические проводимости связаны между собой соотношением:
Λ = xVм = x/cм (5)
где Vм — число кубометров раствора, содержащего 1 г/моль электролита; См — концентрация электролита, выраженная в моль/м3 . Для практических расчетов можно использовать также размерности в производных единицах СИ: [χ]=См см-1 ; [Λ] = См см2 •моль-1 ; [с] = моль/л (моль/дм3 ). При этом вместо уравнения (5) получаем:
(6)
При вычислении молярной электрической проводимости нужно указывать формульную единицу, для которой она вычислена. Так, например, при 298 К в водном растворе при предельном разбавлении A(MgCl2 )=258 · 104 См м2 • моль-1 , но Λ (MgCl2 ) = 129 • 104 См • м2 моль-1 .
Молярная электрическая проводимость с уменьшением концентрации раствора увеличивается и при с → 0 стремится к некоторому предельному максимальному значению Λ∞ , которое называется молярной электрической проводимостью при предельном (бесконечном) разбавлении. Например, для предельно разбавленных растворов НС1, КС1 и NH4 OH значения Λ∞ , при 298 К соответственно равны 426 · 104 ; 149,8 104 и 271,4 104 См м2 моль-1 .
Зависимость молярной электрической проводимости от температуры можно представить уравнением:
ΛТ = Λ298 [1+α (T-298)], (7)
где ΛТ и Λ298 — молярные электрические проводимости при температуре Т = 298 К; α — температурный коэффициент электрической проводимости. Уравнение (7) справедливо для узкого интервала температур. Логарифмируя уравнение (6), получаем:
(8)
Беря производную по температуре от уравнения (8), находим:
, или (9)
Из уравнения (9) следует, что температурные коэффициенты удельной и молярной электрической проводимости одинаковы.
Рассмотрим зависимость молярной электрической проводимости раствора бинарного электролита от скорости движения ионов. Пусть электрический ток проходит через раствор бинарного электролита, помещенный в стеклянную трубку с поперечным сечением s м2 , причем расстояние между электродами равно l м и разность потенциалов между ними равна Е В. Обозначим через u '+ и u'- скорости движения катионов и анионов, м/с, а через см концентрацию раствора электролита, г/моль/м3 . Если степень диссоциации электролита в данном растворе равна α, то концентрации катионов и анионов равны αсм г/моль/м3 . Подсчитаем количество электричества, которое переносится через поперечное сечение трубки за 1 с. Катионов за это время пройдет через сечение u '+ sαc м г/моль и они перенесут u '+ sαc м F Кл электричества, так как г/моль переносит количество электричества, равное числу Фарадея F . Анионы в обратном направлении перенесут u '- sαc м F Кл электричества. Сила тока I, т. е. общее количество электричества, проходящее через данное поперечное сечение раствора в 1 с, равна сумме количеств электричества, переносимого ионами в обоих направлениях:
I = (u'+ + u'- )sαc м F u'+ = u+ (10)
Скорость движения ионов u'+ и u'- прямо пропорциональна напряженности поля E / l :
u'+ = u+ и u'- = u- (11)
где u+ и u- — абсолютные скорости ионов.
Абсолютной скоростью движения иона называется его скорость при единичном градиенте потенциала в 1 В м-1 ; ее размерность [ui ] = В м2 с-1
Подставляязначения u'+ = u' - из уравнения (11) в (10), получаем
I = αF(u+ + u- ) . (12)
С другой стороны, сопротивление R можно выразить через Λ. Учитывая, что из (11) ρ = 1/х и из (5) х = см Λ, получаем из (2) выражение R=l/(хs) = l/(cм Λs). Из закона Ома
I = = Λ. (13)
Приравнивая правые части уравнений (12) и (13) и решая равенство относительно Λ, получаем
Λ= αF(u+ + u- ) (14)
Для сильных электролитов α=1 и
Λ= F(u+ + u- ) (15)
Произведения
Fu+ =λ+ и Fu- =λ- (16)
Называются подвижностями ионов; их размерность [λи ] = См м моль -1 . Например, в водном растворе при 298 К подвижности катионов К + , Ag+ и Mg2+ равны 73,5 · 104 ; 61,9 · 104 и 53,0 · 104 См м2 · моль-1 и подвижности анионов С1-1 , SO4 2- и СН3 СОО- - 76,3 104 ; 80,0 · 104 и 40,9 · 104 См м2 моль-1 соответственно.
Вводя значения λ+ и λ- в (14) и (15), получаем для слабых электролитов:
Λ= α(λ+ + λ- ) (17)
и для сильных электролитов
Λ= λ+ + λ- (18)
Для предельно разбавленного раствора α = 1, поэтому
Λ∞ = λ + λ (19)
где λ и λ - подвижности ионов при предельном разведении. Уравнение (19), справедливое как для сильных, так и для слабых электролитов, называется законом Кольрауша, согласно которому молярная электрическая проводимость при предельном разведении равна сумме подвижностей ионов при предельном разведении. Из уравнения (19) и (16) получаем:
Λ∞ = F(u + u) (20)
где F – постоянная Фарадея; u и u - абсолютные скорости движения ионов при предельном разведении.
1.1.2. Эквивалентная электропроводность
Эквивалентная электропроводность λ [в см2 /(г-экв Ом )вычисляется из соотношения:
(21)
где с — эквивалентная концентрация, г-экв/л.
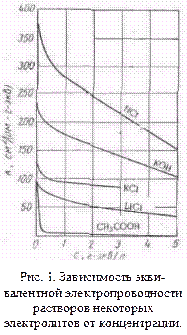 Эквивалентная электропроводность — это электропроводность такого объема (φ см3 ) раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 см друг от друга. Учитывая сказанное выше относительно удельной электропроводности, можно представить себе погруженные в раствор параллельные электроды на расстоянии 1 см., имеющие весьма большую площадь. Мы вырезаем мысленно на поверхности каждого электрода вдали от его краев площадь, равную φ-см2 . Электропроводность раствора, заключенного между выделенными поверхностями таких электродов, имеющими площадь, равную φ- см2 , и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен, очевидно, φ-см3 и содержит один грамм-эквивалент соли. Величина φ, равная 1000/с см3 /г-экв, называется разведением. Между электродами, построенными указанным выше способом, при любой концентрации электролита находится 1 г-экв растворенного вещества и изменение эквивалентной электропроводности, которое обусловлено изменением концентрации, связано с изменением числа ионов, образуемых грамм-эквивалентом, т. е. с изменением степени диссоциации, и с изменением скорости движения ионов, вызываемым ионной атмосферой.
Эквивалентная электропроводность — это электропроводность такого объема (φ см3 ) раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 см друг от друга. Учитывая сказанное выше относительно удельной электропроводности, можно представить себе погруженные в раствор параллельные электроды на расстоянии 1 см., имеющие весьма большую площадь. Мы вырезаем мысленно на поверхности каждого электрода вдали от его краев площадь, равную φ-см2 . Электропроводность раствора, заключенного между выделенными поверхностями таких электродов, имеющими площадь, равную φ- см2 , и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен, очевидно, φ-см3 и содержит один грамм-эквивалент соли. Величина φ, равная 1000/с см3 /г-экв, называется разведением. Между электродами, построенными указанным выше способом, при любой концентрации электролита находится 1 г-экв растворенного вещества и изменение эквивалентной электропроводности, которое обусловлено изменением концентрации, связано с изменением числа ионов, образуемых грамм-эквивалентом, т. е. с изменением степени диссоциации, и с изменением скорости движения ионов, вызываемым ионной атмосферой.
Мольная электропроводность электролита — это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
На рис. 1 показана зависимость эквивалентной электропроводности некоторых электролитов от концентрации. Из рисунка видно, что с увеличением с величина λ уменьшается сначала резко, а затем более плавно.