Курсовая работа: Определение эквивалентной электропроводности уксусной кислоты при бесконечном разбавлении графич
где λ ∞ - предельная эквивалентная электропроводность при бесконечном разведении: с → 0; φ → ∞
Значение λ сильных электролитов растет с увеличением φ и ассимптотически приближается к λ ∞ . Для слабых электролитов (СН3 СООН) значение λ также растет с увеличением φ, но приближение к пределу и величину предела в большинстве случаев практически нельзя установить. Все сказанное выше касалось электропроводности водных растворов. Для электролитов с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например на кривыхλ - с часто наблюдается минимум (аномальная электропроводность).
2. Характеристика уксусной кислоты
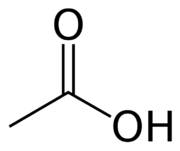
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3 COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
| Уксусная кислота | |
 | |
| Общие | |
| Химическая формула | CH3 COOH |
| Молярная масса | 60,05 г/моль |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,75 |
| Оптические свойства | |
| Показатель преломления | 1,372 |
2. Физические свойства
Ледяная уксусная кислота Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования Δf G0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования Δf S0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл : 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип , °C | массовая доля уксусной кислоты |
| четыреххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
·
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
3. Получение
- Уксусную кислоту можно получить окислением ацетальдегидакислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3 COO)2 при температуре 50-60 °С:
2 CH3 CHO + O2 → 2 CH3 COOH
3. 1. В промышленности
3. 1. 1. Окислительные методы
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
![]()
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
![]()
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
4. Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства. В результате диссоциации уксусной кислоты образуется ацетат-ион CH3 COO− и протон H+ . Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
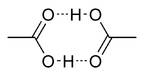
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Mg(тв) + 2CH3 COOH → (CH3 COO)2 Mg + H2
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
CH3 COOH + Cl2 → CH2 ClCOOH + HCl
Этим путем могут быть получены также дихлоруксусная (CCl2 COOH) и трихлоруксусная (CCl3 COOH) кислоты.
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
5. Применение
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавкаE260) и бытовой кулинарии, а также в консервировании.