Курсовая работа: Определение термодинамических параметров реакции полимеризации тетрафторэтилена
![]() гг = -178000+64,2·Т – (-164000+19,2·Т) = -14000 + 45·Т,
гг = -178000+64,2·Т – (-164000+19,2·Т) = -14000 + 45·Т,
а с учетом эмпирической поправки для перехода мономера из газообразного состояния в кристаллический полимер:
![]() гк = -14000 + 45·Т – 4000 + 7,5·Т = -18000 + 52,5·Т [кал/(моль·К)].
гк = -14000 + 45·Т – 4000 + 7,5·Т = -18000 + 52,5·Т [кал/(моль·К)].
При 298 К:
![]() гк (298)= -18000 + 52,5·298 = -2355 кал/моль = -9867,45 Дж/моль;
гк (298)= -18000 + 52,5·298 = -2355 кал/моль = -9867,45 Дж/моль;
Тепловой эффект реакции:
Qр-ии = -∆Н 0 = 18000 кал/моль = 75,42 кДж/моль.
∆S0 гк = 52,5 кал/моль·К= 219,98 Дж/моль·К.
Таким образом, реакция является экзотермической.
![]() .
.
Предельная температура полимеризации:
ТПР = ![]() .
.
8. Выберем температурный интервал и рассчитаем изменение энергии Гиббса, логарифм константы равновесия реакции полимеризации для построения графиков зависимости этих величин от температуры:
Изменение теплоемкости в реакции полимеризации определим как разность между теплоемкостью полимера и теплоемкостью мономера:
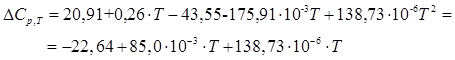
Энтальпию реакции полимеризации можно определить из уравнения Кирхгофа:
![]() .
.
Тогда, после интегрирования:
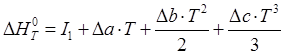 ,
,
где постоянную интегрирования![]() можно определить, подставив в приведенное выше уравнение Т = 298 К,
можно определить, подставив в приведенное выше уравнение Т = 298 К, ![]() Дж/моль:
Дж/моль:
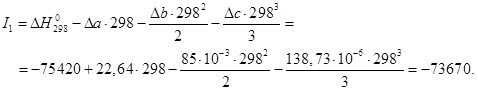
Тогда получим зависимость:
![]() .
.
Поскольку зависимость энергии Гиббса от температуры определяется следующим образом:
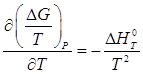 ,
,
то после интегрирования можно записать:
![]() ,
,
откуда постоянную интегрирова- ния I 2 можно определить, подставив ![]() ,
, ![]() Дж/моль:
Дж/моль: