Курсовая работа: Получение медноаммиачного волокна (целлюлозы) химическим методом
и распадатся в водном растворе на ионы:
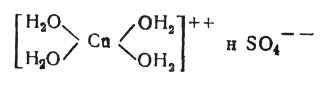 (4)
(4)
Комплексный ион окисной меди с четырьмя молекулами воды – купри-гидроксоион, по Вернеру, [1] – легко обменивает часть или все группы воды на аммиак, на остатки многоосновных спиртов или в особых случаях на кислотные группы (галоген и т.п.).
В первом случае устанавливается равновесие между купригидроксо- и куприамминовым ионами; причем в зависимости от того, какое количество аммиака содержится в водном растворе, в комплексном ионе замещаются на аммиак две или четыре частицы воды:
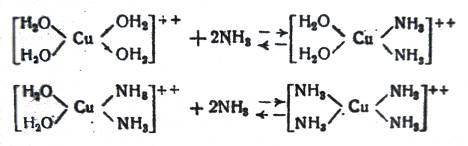
(5)
(6)
По данным Бонсдорфа [2], реакция (5), т.е. образование куприднам-иинового комплексного иона, достигает максимума при концентрации в растворе около 5% NH3 ; при дальнейшем повышении концентрации аммиака образуется купритетрамминовый комплексный ион; при увеличении концентрации аммиака в растворе до 18% все комплексные ионы имеют строение купритетраммина (6).
Таким образом, при насыщении водного раствора медного купороса аммиаком последовательно образуются:
[Cu(OH2 )2 (NH3 )2 ] SO4 и [Cu(NH3 )4 ] SO4 .
Аналогично ведут себя другие соли меди, также образующие в водноаммиач-ном растворе купридиамминовые и купритетрамминовые комплексные соли, например [Cu(NH3 )4 ] Cl2 , [Cu(NH8 )4 ) (NO3 )2 .
При нейтрализации водных растворов комплексных медноаммначных солей едкой щелочью образуются соответственные медноаммиачные основания:

(7)
В отличие от купроддиаминовых солей свободные основания являются нестойкими соединениями и легко распадаются под действием воды до твердой, практически не растворимой в воде гидроокиси меди и аммиака:

(8)
Большое влияние оказывает гидроокись меди. Чистые растворы гидроокиси меди в аммиаке значительно легче растворяют целлюлозу, чем медноаммиачные растворы, содержащие электролиты (например, растворы, полученые при растворении основной соли меди в аммиаке), или растворы с добавлением дигидратирующих веществ (например с добавкой глюкозы).
После одного часа растворения в медноаммиачном растворе, полученной из основной соли меди римерного состава 5Сu(OH) 2 2SO4, содержится 2,5% целлюлозы, тогда как при тех же условиях в медноаммиачном растворе, полученой из чистой гидроокиси меди, растворяется в течении одного часа 3,68% целлюлозы. Однако использовать и получить чистую гидроокись сложно. Так как вещество не стабильное и в природе не встречается в виде гидроксида. Соединение распадается на оксид и воду.
Таким образом если вместо основной соли меди применяется чистая гидроокись меди, растворение целлюлозы осущесвляется быстрее и может быть произведено в одну фазу. Гидроокись меди также сперва вносится в охлажденный водный 25%-ный аммиак, после чего целлюлоза постепенно загружается при перемешивании в образовавшийся раствор купратотетрамингидрата. В этом случае растворение целлюлозы происходит значительно быстрее, и раствор обычно готовят высококонцентрированный содержанием от 20 до 22% целлюлозы.
Возможные процессы и механизмы реакций в процессе получения прядильного раствора
Как уже было подробно изложено выше, растворение целлюлозы можно осуществлять при пользовании основной солью в две стадии или при работе с гидроокисью меди в одну стадию.
В процессе растворения, длящегося около 12 час. к раствору добавляется достаточное количество едкого натра (в виде 7,5%-ного раствора) для создания 5–10% избытка против количества, эквивалентного количеству присутствующих в растворе сульфатных ионов; это обеспечивает завершение растворения и предохраняет оборудование от коррозии. Затем продолжают перемешивание с целью снижения вязкости и добавляют сульфит натрия для регулирования степени снижения вязкости.
Максимальная температура не должна превышать 24°. По окончании растворения масса поступает в большие смесители и разбавляется до получения прядильного раствора следующего состава: 9% целлюлозы, 3,6% меди, 7,0% аммиака.
Первой фазой процесса растворения целлюлозы в медноаммиачном растворе является набухание целлюлозы и образование двойного соединения с купритетраммингидратом типа алкалицеллюпозы Процесс набухания целлюлозы сопровождается выделением тепла, вследствие чего набухание идет лучше при пониженной температуре. При образовании алкалицеллюловы типа 2С6 Н10 О5 . Сu(NH3 )4 (ОН)2 суммарная теплота набухания и образования алкалицеллюлозы, по данным Пакшвера, несколько больше, чем при образовании натронной алкалицеллюлозы, и равна около 27,5 кал/кг 1 .
Параллельно этой главной реакции в первой фазе процесса протекают еще реакции взаимодействия основной соли меда с аммиаком:
CuSO4 + 4NH3 = Cu(NH3 )4 SO4 + 19,1 кал/г-мол. (37)
Cu(OH)2 + 4NH3 = Cu(NH3 )4 (OH)2 + 6,0 кал/г-мол. (38)
В то время как медь, связанная с сернокислой группой, быстро переходит в раствор в виде Cu(NH3 ) 4SO4 при внесении влажной основной соли меди в водный раствор аммиака, медь, связанная с гидроксильными группами, реагирует с аммиаком в первой фазе процесса неполностью из-за небольшой растворимости меди в аммиаке. Суммарная теплота – 53,9 кал/кг целлюлозы.