Курсовая работа: Применение ЭВМ в технологии лекарственных препаратов
![]() , (5)
, (5)
Последующие преобразования основываются на предположениях, что распространение волн де Бройля описывается аналогичным уравнением, и что эти волны становятся стационарными и сферическими. Сначала представим, что по уравнению (5) изменяется значение новой функции ψ от координат (χ, y, z), имеющей смысл амплитуды некоторого колебательного процесса. Тогда, заменяя Еа на ψ, получим волновое уравнение в форме:
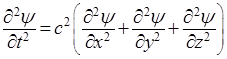 , (6)
, (6)
После исключения t (с помощью (3)) волновое уравнение примет вид:
![]() , (7)
, (7)
где ψ – так называемая волновая функция – величина, периодически изменяющаяся по закону гармонического движения;
ν2 – оператор Лапласа, означающий, что над функцией производится следующее действие:
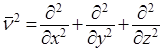 .
.
Будем считать, что волновое уравнение (7) описывает движение частицы. Тогда λ – длина фазовой волны , а ψ – амплитуда фазовой волны в любой произвольно взятой точке χ, y, z, характеризующей местоположение частицы. Длину и амплитуду фазовой волны можно связать с массой и энергией частицы. Если частица движется в потенциальном поле, то ее полная энергия Е складывается из кинетической энергии Ек = mV2 /2 и потенциальной энергии Еп . Отсюда
½mV2 – Е – Еп или m2 V2 = 2m(E – Eп ).
Учитывая соотношение де Бройля, запишем
m2 V2 = h2 /λ2 и λ2 = h2 /2m (E – Eп )
и представим волновое уравнение в следующем виде:
![]() (8)
(8)
В этой форме волновое уравнение называется уравнением Шредингера . Оно является основным уравнением квантовой механики.
Уравнение Шредингера – дифференциальное уравнение в частных производных и может иметь множество решений. Однако физический смысл имеют лишь те ψ-функции (так называемые собственные функции ), которые удовлетворяют ряду условий. Во-первых, эти функции должны быть непрерывными, конечными, однозначными и обращаться в нуль на бесконечном расстоянии. Наложение перечисленных условий называется нормированием ψ-функции. Во-вторых, собственным ψ-функциям соответствуют не любые, а только дискретные значения полной энергии Е. Как дискретные значения энергии, так и вид собственных ψ-функций определяется совокупностью квантовых чисел n, l, m, которые хотя и не содержатся в самом уравнении Шредингера, но вводятся в него при решении. Таким образом, квантование энергии естественно и неизбежно вытекает из основных свойств материальных объектов и не нуждается в особом постулировании, которое было сделано Н. Бором при разработке планетарной модели атома.
2. Ионная (гетерополярная) связь. Расчет энергии ионной связи.
В зависимости от свойств элементов образующие химическую связь электроны могут находиться в различных энергетических и пространственных состояниях, в результате чего в молекулах возникают разные типы связей. С целью классификации выделяют обычно два основных типа связи – ионную и ковалентную. Однако это разделение условно и не отражает многообразия форм химического движения.
Связь называется ионной в том случае, когда между двумя атомами или группами атомов сильно преобладает электростатическое взаимодействие.
Сродством атома к электрону называется количество энергии Е, которое выделяется при присоединении электрона к нейтральному атому или отрицательному иону
![]()
Полусумма энергии ионизации J и энергии сродства к электрону Е, называется электроотрицательностью χ атома, т.е. χ= ½ ( J+ E).
Энергия ионизации и сродство к электрону могут быть вычислены квантово-механическим путем для конкретных оболочек атомов, т.е. с учетом степени гибридизации связей и заселенности орбиталей. В связи с этим все шире используется понятие орбитальной электроноотрицательности (ОЭО) , с помощью которого оценивается способность атома в молекуле к притяжению электрона на данную орбиталь. Метод ЭО позволяет рассчитать эффективные заряды, которые определяются только нормальными валентными связями атомов. В случае дополнительных эффектов (водородные связи, трансвлияние, дативное взаимодействие и т.п.) вычисленные значения зарядов атомов могут существенно отличаться от экспериментальных.
Энергию образования U гетерополярного соединения из атомов можно найти теоретически. Энергия молекулы как функция расстояния r между одновалентными ионами выражается уравнением:
![]()
В этом уравнении разность энергии ионизации первого атома J1 и энергии сродства к электрону второго атома Е2 выражает энергию образования ионов. Энергия электростатического притяжения ионов представлена отрицательным значением члена е2 /r, а энергия отталкивания – функцией b2 /r (обусловлена взаимодействием заполненных электронных оболочек). Постоянная n определяется сжимаемостью кристаллического вещества и обычно равна 10. Значение b можно рассчитать из равновесного значения энергии (минимум энергии, когда r = r0 ):
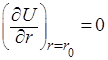 и, следовательно,
и, следовательно,
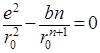 , откуда
, откуда ![]()
Используя это значение b, получим энергию молекулы в равновесном состоянии:
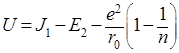 (9)
(9)